题目内容
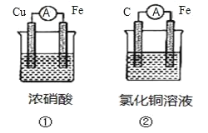
【题目】(1)为了验证 Fe2+与 Cu2+氧化性强弱,下列装置能达到实验目的的是_______(填装置序号), 其正极的电极反应式为_______;若构建该原电池时两个电极的质量相等,当导线中通过 0.4 mol 电子时,两个电极的质量差为_______g。
(2)将 CH4 设计成燃料电池,其利用率更高,装置如图所示(A、B 为多孔碳棒)。

实验测得 OH- 定向移向 A 电极,则_______(填 A 或 B)处电极入口通 CH4,其电极反应式为_______。
(3)金属冶炼和处理常涉及氧化还原反应。由下列物质冶炼相应金属时采用电解法的是_______(填选 项字母)。
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
【答案】② Cu2++2e-=Cu 24 A CH4-8e-+10OH-=CO32-+7H2O b d
【解析】
(1)验证 Fe2+与 Cu2+氧化性强弱,发生反应Fe+Cu2+==Fe2++Cu, 由此反应确定所用装置及正极的电极反应。当导线中通过 0.4 mol 电子时,负极Fe失电子生成Fe2+,质量减轻,正极Cu2+得电子生成Cu,质量增加,两个电极的质量差为两电极质量变化之和。
(2)OH-带负电性,应向负极移动,由此确定A 电极为负极,CH4在碱性溶液中失电子生成CO32-等。
(3)金属冶炼和处理时,由于钾、钙、钠、镁、铝活泼,难以用还原剂还原,所以常使用电解法。
(1)A装置中Cu作负极,发生反应Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O,没有涉及Fe,不能验证 Fe2+与 Cu2+氧化性强弱;要发生反应Fe+Cu2+==Fe2++Cu, 应使用装置②,正极的电极反应为Cu2++2e-=Cu。在电池②中,有如下关系式:Fe—2e—Cu,则参加反应的Fe与生成的Cu都为0.2mol,两个电极的质量差为0.2mol ×64g/mol+0.2mol ×56g/mol=24g。答案为:②;Cu2++2e-=Cu;24;
(2)在原电池中,阳离子向正极移动,阴离子向负极移动,因为OH-向A电极移动,所以A 电极为负极,CH4在KOH溶液中失电子生成CO32-、H2O,电极反应式为CH4-8e-+10OH-=CO32-+7H2O。答案为:A;CH4-8e-+10OH-=CO32-+7H2O;
(3) a.用Fe2O3冶炼Fe,需使用还原剂(常为CO),用还原法炼铁,a不合题意;
b.用NaCl冶炼Na,一般的还原剂不能满足要求,应使用电解法,b符合题意;
c.用Cu2S冶炼Cu,需使用氧化剂(纯氧),用氧化法将Cu2S氧化为Cu,c不合题意;
d.用Al2O3冶炼Al,一般氧化剂不能满足要求,需使用电解法,d符合题意;
故选bd。答案为:bd。

 培优三好生系列答案
培优三好生系列答案