题目内容
【题目】A、B、C 三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
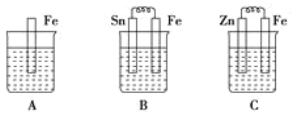
①B中Sn极的电极反应式为__________,Sn极附近溶液的 pH(填“增大”、“减小”或“不变”) __________。
②C中总反应离子方程式为__________,比较 A、B、C 中铁被腐蚀的速率,由快到慢的顺序是__________。
【答案】2H++2e-=H2↑ 增大 Zn+2H+=Zn2++H2 ↑ B>A>C
【解析】
①B中形成Sn-Fe原电池,Fe比Sn活泼,则Sn为正极发生还原反应;
②C中形成Zn-Fe原电池,总反应为Zn+2H+=Zn2++H2↑,电化学腐蚀的速率大于化学腐蚀的速率,金属作原电池正极时得到保护。
①B中形成Sn-Fe原电池,由于Fe比Sn活泼,所以Sn为正极,溶液中的H+在Sn上获得电子,发生还原反应,电极反应式为:2H++2e-=H2↑;由于氢离子不断消耗,所以Sn附近溶液中c(H+)减小,溶液的pH值增大;
②锌比铁活泼,锌为原电池负极,被腐蚀,负极电极反应式为Zn-2e-=Zn2+,正极:2H++2e-=H2↑,总反应方程式为Zn+2H+=Zn2++H2↑。A发生化学腐蚀,B发生电化学腐蚀,C中发生电化学腐蚀,由于锌比铁活泼,所以铁作原电池的正极而被保护,电化学腐蚀的速率大于化学腐蚀的速率,所以由快到慢的顺序是B>A>C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
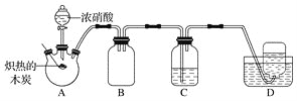
小学生10分钟应用题系列答案【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色 气泡后,迅速停止 | Fe、Cu接触后,其表面 均产生红棕色气泡 |
下列说法中,不正确的是( )
A.Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2=2NO2
B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否持续被氧化