题目内容
【题目】已知某溶液中只存在OH-、H+、NH![]() 、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-)
②c(NH4+)>c(OH-)>c(Cl-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶有一种溶质,则上述四种离子浓度的大小顺序为______(填序号)。
(2)若四种离子的关系符合②,则溶质为________________________。
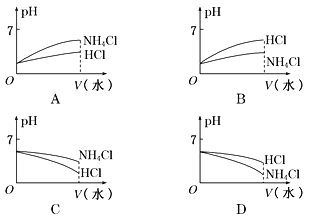
(3)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,则下面图像正确的是______(填图像符号)。
(4) 若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)_____________ c(NH3·H2O)(填“大于”、“小于”或“等于”)。
【答案】① NH4Cl和NH3·H2O B 小于
【解析】
(1)根据溶液中离子浓度大小的关系,判断溶液中含有的溶质的成分;根据c(H+)和c(OH-)的相对大小,判断溶液的酸碱性;根据稀释促进水解,pH相同的强酸和强酸弱碱盐稀释相同的倍数,强酸的pH变化大,以此进行分析判断图像变化;
(1)已知某溶液中只存在OH-、H+、NH![]() 、Cl-四种离子,若溶液中只溶有一种溶质,则溶质为NH4Cl,由于NH
、Cl-四种离子,若溶液中只溶有一种溶质,则溶质为NH4Cl,由于NH![]() 水解,所以c(Cl-)>c(NH4+),水解使溶液显酸性,所以c(H+)>c(OH-),OH-和H+是由水微弱电离产生的,所以c(Cl-)>c(NH4+)>c(H+)>c(OH-),即四种离子浓度的大小顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-),所以答案:①
水解,所以c(Cl-)>c(NH4+),水解使溶液显酸性,所以c(H+)>c(OH-),OH-和H+是由水微弱电离产生的,所以c(Cl-)>c(NH4+)>c(H+)>c(OH-),即四种离子浓度的大小顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-),所以答案:①
(2)若四种离子的关系符合② c(NH4+)>c(OH-)>c(Cl-)>c(H+),说明溶液显碱性,说明一定存在NH3·H2O,同时溶液中存在Cl-,所以是NH4Cl和NH3·H2O的混合液,则溶液的溶质为NH4Cl和NH3·H2O;答案:NH4Cl和NH3·H2O;
(3) NH4Cl为强酸弱碱盐,稀释促进其水解,盐酸为强酸,在溶液中全部电离,pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数时,PH都增大,且盐酸的pH变化大,所以盐酸的pH大于NH4Cl溶液的pH,所以B项符合题意。答案:B。
(4) 因体积、浓度相同的稀盐酸和氨水混合,溶液中的溶质为NH4Cl,溶液显酸性,而该溶液恰好呈中性,则应为氨水与氯化铵的混合溶液,即c(HC1)<c(NH3·H2O);
故答案为:小于。

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案【题目】某温度下,向2L的密闭容器中投入一定量的X和Y,在催化剂的作用下发生反应:X(g)+Y(g) 2Z(g)。反应过程中测定的部分数据如下表:
t/min | n(X)/mol | n(Y)/mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
下列说法正确的是
A.反应0~2min末的平均速率υ(Z)=0.2 mol/(L·min)
B.在2min~4min间,υ(X)正<υ(Y)逆
C.生成2 mol Z的同时消耗1 mol Y能说明该反应已达化学平衡状态
D.其他条件不变,再充入1.2 mol X和0.6 mol Y,X的转化率将减小