题目内容
【题目】下图中,固体A是铁锈的主要成分。
![]()
请回答:
(1)白色沉淀E的化学式____________。
(2)写出A---B的化学方程式_____________________。
(3)写出C---D在溶液中发生氧化还原反应的离子方程式______________________。
【答案】 BaSO4 Fe2O3+3CO![]() 2Fe+3CO2 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
2Fe+3CO2 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
【解析】A是铁锈的主要成分,A为氧化铁,与一氧化碳反应生成单质铁和二氧化碳,铁与氯气反应生成氯化铁,所以固体C为氯化铁,氯化铁与二氧化硫和水反应生成硫酸亚铁,硫酸亚铁溶液中加入氯化钡生成白色沉淀硫酸钡,则E是硫酸钡。
(1)白色沉淀硫酸钡的化学式BaSO4,故答案为:BaSO4;
(2)一氧化碳还原氧化铁的化学方程式为:Fe2O3+3CO![]() 2Fe+3CO2,故答案为:Fe2O3+3CO
2Fe+3CO2,故答案为:Fe2O3+3CO![]() 2Fe+3CO2;
2Fe+3CO2;
(3)氯化铁与二氧化硫与水反应生成硫酸亚铁,反应的离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+。

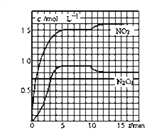
【题目】下列有关反应热的叙述中正确的是
①已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为△H=-241.8 kJ·mol-1
②由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
③X(g)+Y(g)![]() Z(g)+W(s) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大
Z(g)+W(s) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大
④已知:
共价键 | C—C | C===C | C—H | H—H |
键能/(kJ·mol-1) | 348 | 610 | 413 | 436 |
上表数据可以计算出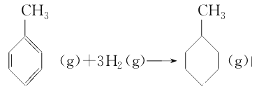 的焓变
的焓变
⑤根据盖斯定律,推知在相同条件下,金刚石或石墨燃烧生成1 mol CO2固体时,放出的热量相等
⑥25℃,101 kPa时,1 mol碳完全燃烧生成CO2所放出的热量为碳的燃烧热
A.①②③④ B.③④⑤ C.④⑤ D.⑥
【题目】向恒温恒容密闭容器中充入气体A,发生反应:xA(g)![]() yB(g)+zC(g),各物质的浓度随时间的变化如下表所示。
yB(g)+zC(g),各物质的浓度随时间的变化如下表所示。
时间/s | c(A)/mol L-1 | c(B)/mol L-1 | c(C)/mol L-1 |
0 | 0.540 | 0 | 0 |
5 | 0.530 | 0.015 | 0.020 |
15 | 0.514 | 0.039 | 0.052 |
30 | 0.496 | 0.066 | 0.088 |
下列说法正确的是
A. x+y=3
B. 若起始时在容器中通入氦气,使容器压强增大,各物质反应速率均加快
C. 随着反应的进行,A的反应速率不断减慢,是因为该反应是吸热反应
D. 0~30 s内B的平均生成速率为2.2×10-3 mol L-1 S-1