题目内容
【题目】Ⅰ.为防治碘缺乏病,通常在食盐中添加少量的碘酸钾(KIO3)。碘酸钾和碘化钾在溶液中能发生下列反应:KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O。
(1)用双线桥标出电子转移的方向和数目___。
(2)该反应中,氧化剂是___,还原剂是____。
Ⅱ.铜绿即是铜锈,它的化学成分是Cu2(OH)2CO3(碱式碳酸铜),铜在潮湿的空气中生锈的化学反应为:2Cu+O2+CO2+H2O=Cu2(OH)2CO3。
(1)用单线桥标出电子转移的方向和数目____。
(2)该反应中的还原剂是____、氧化剂是____。
Ⅲ.氮化铝具有耐高温、抗冲击、导热性好等优良性质,广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可以通过如下方式合成:Al2O3+N2+3C=2AlN+3CO
(1)用单线桥标出该反应中电子转移的方向和数目___。
(2)该反应中的还原剂是___、氧化剂是____。
【答案】 KIO3 KI
KIO3 KI 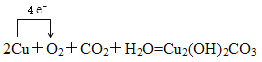 Cu O2
Cu O2 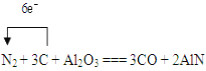 C N2
C N2
【解析】
Ⅰ.KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O,KIO3中碘元素化合价由+5降低为0,KI中氮元素化合价由-1升高为0;
Ⅱ.反应2Cu+O2+CO2+H2O=Cu2(OH)2CO3,Cu元素化合价由0升高为+2,O2中O元素化合价由0降低为-2;
Ⅲ. Al2O3+N2+3C=2AlN+3CO,N2中N元素化合价由0降低为-3,C元素化合价由0升高为+2;
Ⅰ.(1)KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O,KIO3中碘元素化合价由+5降低为0,KI中氮元素化合价由-1升高为0,电子转移的方向和数目是 ;
;
(2)所含元素化合价降低的反应物为氧化剂,所含元素化合价升高的反应物为还原剂,KIO3中碘元素化合价由+5降低为0,所以KIO3是氧化剂;KI中氮元素化合价由-1升高为0,所以KI是还原剂;
Ⅱ. (1)反应2Cu+O2+CO2+H2O=Cu2(OH)2CO3,Cu元素化合价由0升高为+2,O2中O元素化合价由0降低为-2,电子转移的方向和数目是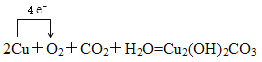 ;
;
(2)所含元素化合价降低的反应物为氧化剂,所含元素化合价升高的反应物为还原剂,Cu元素化合价由0升高为+2,所以Cu是还原剂;O2中O元素化合价由0降低为-2,所以O2是氧化剂;
Ⅲ. (1)反应Al2O3+N2+3C=2AlN+3CO,N2中N元素化合价由0降低为-3,C元素化合价由0升高为+2,电子转移的方向和数目是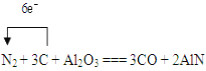 ;
;
(2)所含元素化合价降低的反应物为氧化剂,所含元素化合价升高的反应物为还原剂,C元素化合价由0升高为+2,所以C是还原剂;N2中N元素化合价由0降低为-3,所以N2是氧化剂;







