题目内容
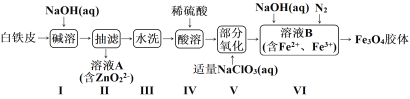
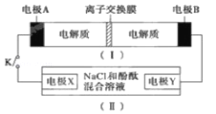
【题目】阳离子交换膜法电解饱和食盐水具有综合能耗低、环境污染小等优点。生产流程如下图所示:
(1)电解饱和食盐水的化学方程式为________。
(2)电解结束后,能够脱去阳极液中游离氯的试剂或方法是________(填字母序号)。
a.Na2SO4b.Na2SO3
c.热空气吹出d.降低阳极区液面上方的气压
(3)食盐水中的I—若进入电解槽,可被电解产生的Cl2氧化为ICl,并进一步转化为IO3—。IO3—可继续被氧化为高碘酸根(IO4—),与Na+结合生成溶解度较小的NaIO4沉积于阳离子交换膜上,影响膜的寿命。
①从原子结构的角度解释ICl中碘元素的化合价为+1价的原因:________。
②NaIO3被氧化为NaIO4的化学方程式为________。
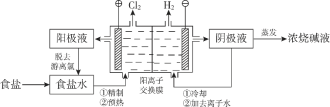
(4)在酸性条件下加入NaClO溶液,可将食盐水中的I-转化为I2,再进一步除去。通过测定体系的吸光度,可以检测不同pH下I2的生成量随时间的变化,如下图所示。已知:吸光度越高表明该体系中c(I2)越大。

①结合化学用语解释10 min时不同pH体系吸光度不同的原因:________。
②pH=4.0时,体系的吸光度很快达到最大值,之后快速下降。吸光度快速下降的可能原因:________。
③研究表明食盐水中I-含量≤0.2 mgL-1时对离子交换膜影响可忽略。现将1m3含I-浓度为1.47 mgL-1 的食盐水进行处理,为达到使用标准,理论上至少需要0.05 molL-1 NaClO溶液________L。(已知NaClO的反应产物为NaCl,溶液体积变化忽略不计)
【答案】2 NaCl + 2H2O ![]() C12↑ + H2↑+ 2NaOH bcd 碘元素和氯元素处于同一主族(VIIA),二者最外层电子数均为7,ICl中共用一对电子,由于碘原子半径大于氯原子,碘原子得电子能力弱于氯原子,故共用电子对偏离碘原子,使得碘元素显+1价 Na++IO3—+ Cl2 + H2O=== NaIO4↓+ 2H++2Cl— ClO- + 2H+ + 2I-=== I2 + Cl- + H2O10 min时pH越低,c(H+)越大,反应速率加快(或ClO-氧化性增强),c(I2)越高,吸光度越大。 c(H+)较高,ClO-继续将I2 氧化为高价含碘微粒,c(I2)降低,吸光度下降 0.1
C12↑ + H2↑+ 2NaOH bcd 碘元素和氯元素处于同一主族(VIIA),二者最外层电子数均为7,ICl中共用一对电子,由于碘原子半径大于氯原子,碘原子得电子能力弱于氯原子,故共用电子对偏离碘原子,使得碘元素显+1价 Na++IO3—+ Cl2 + H2O=== NaIO4↓+ 2H++2Cl— ClO- + 2H+ + 2I-=== I2 + Cl- + H2O10 min时pH越低,c(H+)越大,反应速率加快(或ClO-氧化性增强),c(I2)越高,吸光度越大。 c(H+)较高,ClO-继续将I2 氧化为高价含碘微粒,c(I2)降低,吸光度下降 0.1
【解析】
(1)电解时,阳极失电子发生氧化反应,阴极得电子发生还原反应,两极合并为电解池总反应。
(2)a. Na2SO4与游离氯不反应,不能除去阳极液中游离氯;
b. Na2SO3有还原性,游离氯有强氧化性,两者发生氧化还原反应,则Na2SO3有可以除去阳极液中游离氯;
c.海水中提取溴用到“空气吹出法”将游离态的溴吹出,则除去阳极液中游离氯也可采取此方法;
d.由于气体的溶解度随压强的减小而减小,则降低阳极区液面上方的气压,游离氯的溶解度减小从液体中逸出,可除去阳极液中游离氯。
(3)①本小题考查的是对共价键的理解,碘元素和氯元素处于同一主族(VIIA),二者最外层电子数均为7,ICl中共用一对电子,由于碘原子半径大于氯原子,碘原子得电子能力弱于氯原子,故共用电子对偏离碘原子,使得碘元素显+1价。
②氧化还原反应中,物质中元素化合价升高失电子发生氧化反应,该物质作还原剂,生成的产物为氧化产物,物质中元素化合价降低得电子发生还原反应,该物质做氧化剂,生成的产物为还原产物,由此找出反应物和生成物,在根据得失电子守恒配平氧化还原反应。
(4)①本小题涉及速率的影响因素,增大反应物的浓度速率加快,则c(H+)越大,反应速率加快(或ClO-氧化性增强),c(I2)越高,吸光度越大。
②c(H+)较高,ClO-继续将I2 氧化为高价含碘微粒,c(I2)降低,吸光度下降。
③本小题涉及物质的量、物质的量浓度在氧化还原反应中的计算。
(1)电解饱和食盐水时,氯离子在阳极失电子发生氧化反应生成氯气,水电离的氢离子在阴极得电子发生还原反应生成氯气,则电解的化学方程式为2NaCl +2H2O ![]() C12↑+ H2↑+2NaOH。本小题答案为:2NaCl +2H2O
C12↑+ H2↑+2NaOH。本小题答案为:2NaCl +2H2O ![]() C12↑+ H2↑+2NaOH。
C12↑+ H2↑+2NaOH。
(2)a. Na2SO4与游离氯不反应,不能除去阳极液中游离氯,故a不符合题意;
b. Na2SO3有还原性,游离氯有强氧化性,两者发生氧化还原反应,则Na2SO3有可以除去阳极液中游离氯,故b符合题意;
c.海水中提取溴用到“空气吹出法”将游离态的溴吹出,则除去阳极液中游离氯也可采取此方法,故c符合题意;
d.由于气体的溶解度随压强的减小而减小,则降低阳极区液面上方的气压,游离氯的溶解度减小从液体中逸出,可除去阳极液中游离氯,故d符合题意。答案选bcd。
(3)①碘元素和氯元素处于同一主族(VIIA),二者最外层电子数均为7,ICl中共用一对电子,由于碘原子半径大于氯原子,碘原子得电子能力弱于氯原子,故共用电子对偏离碘原子,使得碘元素显+1价。本小题答案为:碘元素和氯元素处于同一主族(VIIA),二者最外层电子数均为7,ICl中共用一对电子,由于碘原子半径大于氯原子,碘原子得电子能力弱于氯原子,故共用电子对偏离碘原子,使得碘元素显+1价。
②NaIO3中I元素失电子发生氧化反应,化合价由+5价升高到+7价生成NaIO4,Cl2中氯元素得电子发生还原反应,化合价由0价降低到-1价生成Cl-,离子方程式为Na++IO3—+ Cl2 + H2O=== NaIO4↓+ 2H++2Cl—。本小题答案为:Na++IO3—+ Cl2 + H2O=== NaIO4↓+ 2H++2Cl—。
(4)①ClO- + 2H+ + 2I-=== I2 + Cl- + H2O 10 min时pH越低,c(H+)越大,反应速率加快(或ClO-氧化性增强),c(I2)越高,吸光度越大。本小题答案为:ClO- + 2H+ + 2I-=== I2 + Cl- + H2O 10 min时pH越低,c(H+)越大,反应速率加快(或ClO-氧化性增强),c(I2)越高(1分),吸光度越大。
②c(H+)较高,ClO-继续将I2 氧化为高价含碘微粒,c(I2)降低,吸光度下降。本小题答案为:c(H+)较高,ClO-继续将I2 氧化为高价含碘微粒,c(I2)降低,吸光度下降。
③研究表明食盐水中I-含量≤0.2 mgL-1时对离子交换膜影响可忽略。即1m3食盐水中I-的含量≤0.2 mgL-1×1m3×1000=0.2g时对离子交换膜影响可忽略,则1m3含I-浓度为1.47 mgL-1 的食盐水需处理掉1.47 mgL-1×1m3-0.2g=1.27g的I-时对离子交换膜影响可忽略。1.27gI-的物质的量为0.01mol,根据反应方程式ClO- + 2H+ + 2I-=== I2 + Cl- + H2O,需NaClO的物质的量为0.005mol,则此NaClO的体积为0.005mol/0.05mol/L=0.1L。本小题答案为:0.1。

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案【题目】纪录片《我在故宫修文物》表现了文物修复者穿越古今与百年之前的人进行对话的职业体验,让我们领略到历史与文化的传承。下列文物修复和保护的过程中涉及化学变化的是
A | B | C | D |
|
|
|
|
银器用除锈剂见新 | 变形的金属香炉复原 | 古画水洗除尘 | 木器表面擦拭烫蜡 |
A. AB. BC. CD. D
【题目】某实验小组同学把小块木炭在酒精灯上烧至红热,迅速投入热的浓硝酸中,发生剧烈反应,同时有大量红棕色气体产生,液面上木炭迅速燃烧发出亮光。经查阅资料可知浓硝酸分解产生NO2和O2。为了探究“液面上木炭迅速燃烧发出亮光”的原因,该小组同学用如图装置完成以下实验:
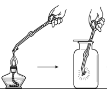
序号 | 实验I | 实验II |
集气瓶中所盛气体 | O2 | 加热浓硝酸 产生的气体 |
现象 | 木炭迅速燃烧发出亮光 | 木炭迅速燃烧发出亮光 |
下列说法正确的是
A. 浓硝酸分解产生的V(NO2):V(O2)=1:1
B. 红棕色气体的产生表明木炭与浓硝酸发生了反应
C. 能使液面上木炭迅速燃烧发出亮光的主要气体是氧气
D. 以上实验不能确定使液面上木炭迅速燃烧发出亮光的主要气体一定是NO2