题目内容
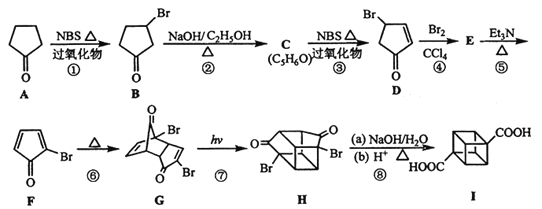
【题目】立方烷(![]() )具有高度的对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点。下面是立方烷衍生物I的一种合成路线:
)具有高度的对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点。下面是立方烷衍生物I的一种合成路线:
回答下列问题:
(1)C的结构简式为___________,E的结构简式为_______________。
(2)③的反应类型为___________,⑤的反应类型为_______________。
(3)化合物A可由环戊烷经三步反应合成,已知:反应1的试剂与条件为:Cl2/光照。
![]()
反应2的化学方程式为_____________________________________。
(4)在立方烷衍生物I的合成路线中,互为同分异构体的化合物是__________(填化合物代号)。
(5)立方烷衍生物I与碱石灰共热可转化为立方烷。立方烷的核磁共振氢谱中有________个峰。
【答案】![]()
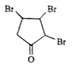 取代反应 消去反应
取代反应 消去反应 ![]() +NaOH
+NaOH![]()
![]() +NaCl G和H 1
+NaCl G和H 1
【解析】
A发生取代反应生成B,B发生消去反应生成C,C为![]() ,C发生取代反应生成D,D与Br2/CCl4发生加成反应生成E,E为
,C发生取代反应生成D,D与Br2/CCl4发生加成反应生成E,E为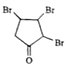 ,对比E和F的结构简式,E发生消去反应生成F
,对比E和F的结构简式,E发生消去反应生成F 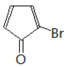 ,据此分析解答。
,据此分析解答。
A发生取代反应生成B,B发生消去反应生成C,C为![]() ,C发生取代反应生成D,D与Br2/CCl4发生加成反应生成E,E为
,C发生取代反应生成D,D与Br2/CCl4发生加成反应生成E,E为 ,对比E和F的结构简式,E发生消去反应生成F
,对比E和F的结构简式,E发生消去反应生成F  ;
;
(1)根据上述推断,C的结构简式为![]() ,E的结构简式为
,E的结构简式为 ;
;
(2)通过以上分析中,③的反应类型为取代反应,⑤的反应类型为消去反应;
(3)环戊烷和氯气在光照条件下发生取代反应生成X,X为![]() ,X和氢氧化钠的水溶液加热发生取代反应生成Y,Y为
,X和氢氧化钠的水溶液加热发生取代反应生成Y,Y为![]() ,Y在铜作催化剂加热条件下发生氧化反应生成环戊酮
,Y在铜作催化剂加热条件下发生氧化反应生成环戊酮![]() 。反应2的化学方程式为
。反应2的化学方程式为![]() +NaOH
+NaOH![]()
![]() +NaCl;
+NaCl;
(4)在I的合成路线中,互为同分异构体的化合物是G和H;
(5)I与碱石灰共热可化为立方烷,核磁共振氢谱中氢原子种类与吸收峰个数相等,立方烷中氢原子种类是1,因此立方烷的核磁共振氢谱中有1个峰。

 应用题天天练四川大学出版社系列答案
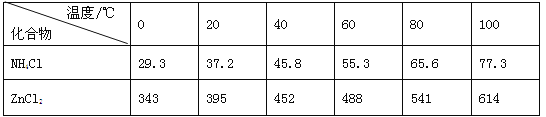
应用题天天练四川大学出版社系列答案【题目】酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的正极反应式为___,电池反应的离子方程式为___。
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn___g。(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过___分离回收;滤渣的主要成分是MnO2、___和_______,欲从中得到较纯的MnO2,最简便的方法是___,其原理是___。
【题目】“84消毒液”广泛应用于杀菌消毒,其有效成分是NaClO。实验小组制备消毒液,并利用其性质探索制备碘水的方法。
资料:i.HClO的电离常数为Ka=4.7×10-8;
H2CO3的电离常数为K1=4.3×10-7、K2=5.6×10-11。
ii.碘的化合物主要以I-和IO3-的形式存在,IO3-+5I-+6H+=3I2+3H2O。
iii.碘单质能与I-反应:I2+I-![]() I3-(I3-低浓度时显黄色,高浓度时为棕色)。
I3-(I3-低浓度时显黄色,高浓度时为棕色)。
Ⅰ.制备消毒液(夹持装置略)
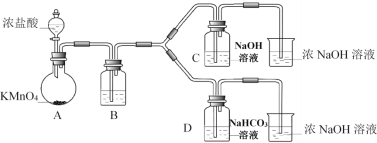
(1)制备NaClO消毒液的装置是__________(填C或D)。
(2)制备完成后,向C装置的溶液中添加NaOH、Na2SiO3等物质,得到与某品牌成份相同的消毒液,用平衡移动原理解释NaOH的作用___________________。
(3)结合资料i,写出D中反应的化学方程式______________________。
Ⅱ.利用消毒液的性质探究碘水的制备方法
将某品牌“84消毒液”稀释10倍,各取100mL于三个烧杯中,设计如下实验方案制备碘水:
方案 | 操作 | 现象 | 反应后加淀粉溶液 |
1 | 烧杯1溶液中加入9gKI固体 | 溶液为橙黄色 | …… |
2 | 烧杯2溶液中加入9gKI固体再加入1mo/L盐酸10mL | 溶液颜色快速加深,呈紫红色 | 变蓝 |
3 | 烧杯3溶液中加入少量KI固体(小于0.5g) | 振荡后溶液保持无色 | 不变蓝 |
(4)对比不同方案的实验现象,得出制取碘水的最佳方法要关注的因素是________。
(5)针对烧杯3“滴加淀粉溶液不变蓝”的原因,提出两种假设:
假设1:过量的NaClO将反应生成的I2氧化为IO3-。
设计实验证实了假设1成立。NaClO氧化I2生成IO3-的离子方程式是_____________。
假设2:生成的I2在碱性溶液中不能存在。
设计实验a证实了假设2成立,实验a的操作及现象是______________________。
(6)某小组检验烧杯3所得溶液中含IO3-:取烧杯3所得无色溶液少许,加入稀硫酸酸化的KI溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在IO3-,说明理由______________________。
(7)预测烧杯1反应后加淀粉溶液的实验现象,结合方程式说明预测依据________。