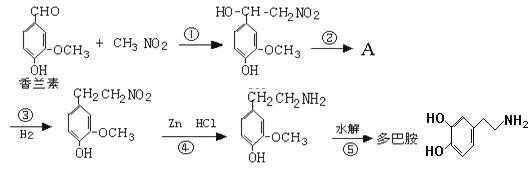
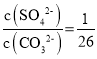题目内容
【题目】下列实验方案中不能达到相应实验目的的是
选项 | A | B | C | D |
方案 |
滴管内盛有不同浓度的H2C2O4溶液 |
|
|
|
目的 | 探究浓度对化学反应速率的影响 | 探究催化剂对H2O2分解速率的影响 | 室温下比较NaHCO3和Na2CO3的溶解度 | 探究温度对化学平衡的影响 |
A. AB. BC. CD. D
【答案】B
【解析】
本题主要考查了实验探究过程中控制变量法的运用。
由图可知,两实验变量是H2C2O4溶液浓度,故探究浓度对化学反应速率的影响,A正确;
由图可知,实验并不存在唯一变量,过氧化氢浓度不相等,故不能探究催化剂对H2O2分解速率的影响,B错误;
由图可知,实验变量只是碳酸钠和碳酸氢钠,故可以比较NaHCO3和Na2CO3的溶解度,C正确;
将二氧化氮放于两种环境中,通过观察颜色变化,探究温度对化学平衡的影响,D正确;
答案为B。

练习册系列答案
相关题目
【题目】某温度下,反应H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=![]() 。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
甲 | 乙 | 丙 | |
c(H2)/(mol·L-1) | 0.010 | 0.020 | 0.020 |
c(CO2)/(mol·L-1) | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A. 反应开始时,丙容器中化学反应速率最大,甲容器中化学反应速率最小
B. 平衡时,乙容器中CO2的转化率大于60%
C. 平衡时,甲容器中和丙容器中H2的转化率均是60%
D. 平衡时,丙容器中c(CO2)是甲容器中的2倍,是 0.012 mol·L-1