题目内容
【题目】25℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.6×10-9。该温度下,下列说法不正确的是( )
A.BaCO3的悬浊液中加入少量的新制氯水,c(Ba2+)增大
B.BaSO4悬浊液中加入Na2CO3浓溶液,BaSO4不可能转化为BaCO3
C.BaSO4和BaCO3共存的悬浊液中, 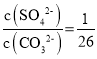
D.同浓度的Na2SO4和Na2CO3混合溶液中滴加BaCl2溶液,BaSO4先析出
【答案】B
【解析】
A.BaCO3的悬浊液中存在沉淀溶解平衡,加入氯水,c(CO32-)的浓度减小,沉淀溶解平衡正移,所以c(Ba2+)增大,故A正确;
B.当Qc=c(CO32-)c(Ba2+)≥Ksp(BaCO3),就能转化为BaCO3,所以当c(CO32-)足够大时,能满足Qc=c(CO32-)c(Ba2+)≥Ksp(BaCO3),所以BaSO4能转化为BaCO3,故B错误;
C.根据Ksp(BaSO4 )和Ksp(BaCO3)计算可求出中![]() =
=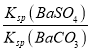 =
=![]() ,故C正确;
,故C正确;
D.25℃时,Ksp(BaSO4)=1×10-10,Ksp (BaCO3)=2.6×10-9,物质Ksp小的容易生成沉淀,所以同浓度的Na2SO4和Na2CO3混合溶液中滴加BaCl2溶液,BaSO4先析出,故D正确;
故选B。

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
【题目】下列实验方案中不能达到相应实验目的的是
选项 | A | B | C | D |
方案 |
滴管内盛有不同浓度的H2C2O4溶液 |
|
|
|
目的 | 探究浓度对化学反应速率的影响 | 探究催化剂对H2O2分解速率的影响 | 室温下比较NaHCO3和Na2CO3的溶解度 | 探究温度对化学平衡的影响 |
A. AB. BC. CD. D