题目内容
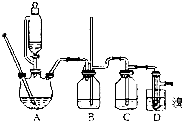
10.N2在诸多领域用途广泛.某化学兴趣小组为探究在实验室制备较为纯净N2的方法,进行了认真的准备.请你参与交流与讨论.【查阅资料】N2的制法有下列三种方案:
方案1:加热NaNO2和NH4Cl的浓溶液制得N2.
方案2:加热条件下,以NH3还原CuO可制得N2,同时获得活性铜粉.
方案3:将空气缓缓通过灼热的铜粉获得较纯的N2.
【实验准备】以实验室常见仪器(药品)等设计的部分装置如下图(有的夹持和加热仪器未画出).
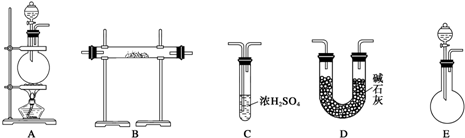
【分析交流】
(1)若以方案1制得N2,应选择的发生装置是A.
(2)若按方案2制得干燥、纯净的N2,且需要的NH3以生石灰和浓氨水作原料,整套制气装置按气流从左到右的连接顺序是(填写序号)E→D→B→C.获得N2的反应原理是(写反应方程式)2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O.
(3)若以排水法收集N2,其中会混入水蒸气.但也不宜用排空气法,其原因是N2的相对分子质量28与空气的平均相对分子质量相近(用气体密度大小比较回答问题也给分).
你提出的收集方法是用塑料袋直接收集.
(4)上述三个方案中,制得的N2纯度最差的是方案3.在N2纯度要求不甚严格的情况下,有人建议将方案2和方案3结合使用,你认为其优点是Cu 和 CuO 可以循环使用,节省药品.
分析 (1)若以方案1加热NaNO2和NH4Cl的浓溶液制得N2,反应物状态是固液混合、反应条件是加热,应该选用固液加热型装置;
(2)若按方案2制得干燥、纯净的N2,且需要的NH3以生石灰和浓氨水作原料,先用生石灰和浓氨水混合制取氨气,然后用碱石灰干燥氨气,将氨气和CuO加热制取氮气,再用酸吸收未反应的氨气,最后获取干燥、纯净的氮气;在加热条件下,氨气和CuO加热生成Cu和氮气;
(3)氮气和空气相对分子质量接近,所以不宜采用排空气法收集;可以用塑料袋直接收集;
(4)根据制备方案中氮气纯度分析.在N2纯度要求不甚严格的情况下,方案2和方案3中Cu 和 CuO 可以循环使用.
解答 解:(1)若以方案1加热NaNO2和NH4Cl的浓溶液制得N2,反应物状态是固液混合、反应条件是加热,应该选用固液加热型装置,故选A;
(2)若按方案2制得干燥、纯净的N2,且需要的NH3以生石灰和浓氨水作原料,先用生石灰和浓氨水混合制取氨气,不需要加热,应该选取固液混合不加热型装置,故选B;然后用碱石灰干燥氨气,选D;将氨气和CuO加热制取氮气,选B;再用酸吸收未反应的氨气,选C;最后获取干燥、纯净的氮气,所以仪器连接顺序是E→D→B→C;在加热条件下,氨气和CuO加热生成Cu和氮气,反应方程式为2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O,
故答案为:E→D→B→C;2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O;
(3)N2的相对分子质量28与空气的平均相对分子质量相近,故不宜用排空气法;可直接用塑料袋收集,
故答案为:N2的相对分子质量28与空气的平均相对分子质量相近(用气体密度大小比较回答问题也给分);以塑料袋直接收集;
(4)从制备过程看,方案1和2能得到纯净的氮气,而方案3制取的氮气中混有稀有气体、二氧化碳、水蒸气等物质,所以方案3氮气纯度最差;方案2和3反应原理简单,原料来源多,铜和氧化铜可以循环利用;
故答案为:方案3;Cu 和 CuO 可以循环使用,节省药品.
点评 本题考查气体制备实验方案设计,为高频考点,明确实验原理及实验基本操作过程是解本题关键,会从实验原理及实验步骤方面进行评价,难点是仪器连接顺序,题目难度中等.

| A. | NaCl溶液中离子的总浓度和NaClO溶液中离子的总浓度相等 | |
| B. | NaCl溶液中离子的总浓度大于NaClO溶液中离子的总浓度 | |
| C. | NaCl溶液中离子的总浓度小于NaClO溶液中离子的总浓度 | |
| D. | NaCl溶液的pH大于NaClO溶液的pH |
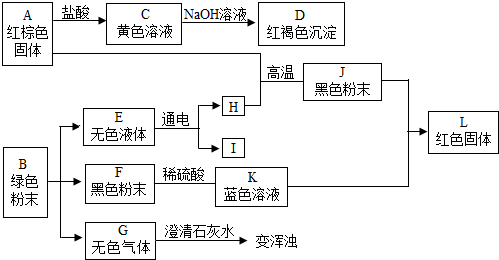
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:①CH3CH2OH②$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O
②CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用16.0g的溴和足量的乙醇制备1,2-二溴乙烷,实验结束后得到9.4g产品.实验装置如图所示:有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/0C | 78.5 | 132 | 34.6 |
| 熔点/0C | -130 | 9 | -116 |
| 溶解性 | 易溶水 | 难溶水 | 微溶于水 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其主要目的是d;(填正确选项前的字母)
a、引发反应b、加快反应速度c、防止乙醇挥发d、减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
a、水b、浓硫酸c、氢氧化钠溶液d、酸性KMnO4溶液
(3)判断该制备反应已经结束的最简单的方法是溴的颜色完全褪去.
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”或“下”);
(5)在装置B中较长玻璃导管的作用是防止倒吸、判断装置是否堵塞;
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发,但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞;
(7)本实验中,1,2-二溴乙烷的产率为50%.
| A. | 纯水的导电性很差,所以水不是电解质 | |
| B. | SO3水溶液的导电性很好,所以SO3是电解质 | |
| C. | 液态的铜导电性很好,所以铜是电解质 | |
| D. | Na2O液态时能导电,所以Na2O是电解质 |
| A. | 单质:⑥⑦ | B. | 氧化物:②⑨ | C. | 碱:①④ | D. | 有机物:③⑤ |
 l,2二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.189cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室中可用下列反应制备1,2二溴乙烷.
l,2二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.189cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室中可用下列反应制备1,2二溴乙烷. 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线: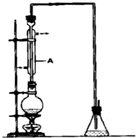 溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应.某课外小组欲在实验室制备溴乙烷的装置如右图,实验操怍步骤如下:
溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应.某课外小组欲在实验室制备溴乙烷的装置如右图,实验操怍步骤如下: