题目内容
【题目】欲测定某NaOH溶液的物质的量浓度,可用0.100mol/L的HCl标准溶液进行中和滴定(用甲基橙作指示剂)。 请回答下列问题:
(1)滴定前,用移液管量取待测NaOH溶液于 _____中( 填仪器名称),并加入2~3滴指示剂;
(2)盛装标准盐酸的仪器名称为 _____ ;
(3)如何判断滴定终点(需写出颜色变化) __________ ;
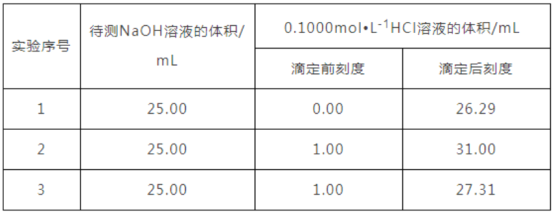
某学生做了三组平行实验,数据记录如下:
选取下述合理数据,算出待测NaOH溶液的物质的量浓度为 _______________;
(保留四位有效数字)
(4)下列哪些操作会使测定结果偏低____________
a.反应容器用蒸馏水洗净后,未用待测液润洗
b.滴定前,平视读数;滴定后,仰视读数
c.滴定前,尖嘴无气泡;滴定后,尖嘴出现气泡
【答案】锥形瓶 酸式滴定管 溶液由黄色变成橙色,且30秒内不变回黄色 0.1052mol/L c
【解析】
根据酸碱中和滴定的步骤和滴定原理进行分析判断即可。
(1)用0.100mol/L的HCl标准溶液对未知浓度的NaOH溶液进行中和滴定,NaOH溶液为待测溶液,应盛装在锥形瓶中;答案:锥形瓶。
(2)盐酸溶液为标准溶液,应盛装在酸式滴定管中;答案:酸式滴定管。
(3)在本次滴定实验中,采用甲基橙作指示剂,当到达滴定终点时,滴入最后一滴盐酸,锥形瓶中的溶液由黄色变为橙色且半分钟内不褪色。答案:溶液由黄色变成橙色,且30秒内不变回黄色。
(4)三组实验中,消耗标准溶液盐酸的体积分别为26.29 mL、30.00mL、26.31mL,观察数据可知,第二组实验误差较大,应舍去,故消耗HCl标准溶液的平均体积为(26.31mL+26.29mL)/2=26.30mL,待测NaOH溶液的物质的量浓度为:c(NaOH)=v(HCl)·c(HCl)/v(NaOH)=26.30mL×0.100mol/L/25.00mL=0.1052mol/L。
(5)a.反应容器指的是锥形瓶,用蒸馏水洗净后,未用待测液润洗,不会影响测定结果,故不会偏低;
b.滴定前平视读数,滴定后仰视读数体积读大了,使消耗的体积偏大,测定结果偏高;
c.滴定前尖嘴无气泡;滴定后尖嘴出现气泡使测定消耗的体积变小了,导致测定结果偏低。
故答案选c。

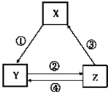
【题目】下列各组物质之间通过一步反应能实现如图所示转化关系,且与表中条件也匹配的是( )
选项 | X | Y | Z | 箭头上为反应条件或试剂 |
|
A | Fe | FeCl2 | FeCl3 | ①通入少量Cl2 | |
B | Na2CO3 | NaCl | NaHCO3 | ②先通CO2,再通过量NH3 | |
C | MgO | MgCl2 | Mg(OH)2 | ③加热 | |
D | NaAlO2 | Al(OH)3 | Al2O3 | ④加水 |
A.AB.BC.CD.D
【题目】下列实验操作和现象所得结论正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 向某无色溶液中滴加稀盐酸 | 溶液变浑浊 | 原溶液中一定存在 |
B | 向某无色溶液中滴加稀NaOH溶液 | 未观察到明显现象 | 原溶液中一定不存在 |
C | 向酸性 | 溶液紫红色褪去 |
|
D | 向某溶液中通入 | 溶液变红 | 原溶液中一定含有 |
A.AB.BC.CD.D