��Ŀ����
����Ŀ��ԭ���������������A��B��C��D��E��F����Ԫ�أ�����A�Ļ�̬ԭ����3����ͬ�ܼ������ܼ��еĵ�������ȣ�C�Ļ�̬ԭ��2p�ܼ��ϵ�δ�ɶԵ�������Aԭ�ӵ���ͬ��DΪ������������ԭ�Ӱ뾶��������Ԫ�أ�E��F��Cλ��ͬһ���壬F���ڵ�һ�������ڣ�
��1��F ԭ�ӻ�̬����Χ��������Ų�ʽΪ ��
��2����A��B��C�γɵ�����CAB����AC2��Ϊ�ȵ����壬��CAB���ĽṹʽΪ ��
��3����Ԫ��A��E���γɵij����������У�Aԭ�ӹ�����ӻ�����Ϊ ��
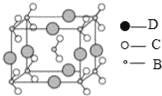
��4����B��C��D����Ԫ���γɵĻ����ᄃ��ľ�����ͼ��ʾ����û�����Ļ�ѧʽΪ ��
��5��PM2.5�����������ж����к����ʣ����������ι⻯ѧ������Ⱦ���⻯ѧ�����к���NOx��CH2�TCHCHO��HCOOH��CH3COONO2��PAN���ȶ�����Ⱦ�
������˵����ȷ���� ��
A��N2OΪֱ���ͷ���
B��C��N��O�ĵ�һ��������������
C��CH2�TCHһCHO������̼ԭ�Ӿ�����sp2�ӻ�
D����ͬѹǿ�£�HCOOH�е��CH3OCH3�ߣ�˵��ǰ���Ǽ��Է��ӣ������ǷǼ��Է���
��NO�ܱ�FeSO4��Һ�������������[Fe��NO����H2O��5]SO4��������������ӵ�����Ϊ �������ṩ�չ������ ���������ţ�
���𰸡���1��4s24p4��
��2�� [N=C=O]����
��3��sp��
��4��NaNO2��
��5����AC��
��NO��H2O��Fe2+��
�����������������ԭ���������������A��B��C��D��E��F����Ԫ�أ�����A�Ļ�̬ԭ����3����ͬ���ܼ������ܼ��еĵ�������ȣ�ԭ�Ӻ�������Ų�ʽΪ1s22s22p2����AΪ̼Ԫ�أ�C�Ļ�̬ԭ��2p�ܼ��ϵ�δ�ɶԵ�������Aԭ�ӵ���ͬ����Cԭ�Ӻ�������Ų�ʽΪ1s22s22p4����CΪOԪ�أ���ԭ��������֪BΪNԪ�أ�E��F��Cλ��ͬһ���壬F���ڵ�һ�������ڣ���EΪSԪ�أ�FΪSe��DΪ������������ԭ�Ӱ뾶��������Ԫ�أ�������A�壬ԭ����������OԪ����С����DΪNa��
�⣺ԭ���������������A��B��C��D��E��F����Ԫ�أ�����A�Ļ�̬ԭ����3����ͬ���ܼ������ܼ��еĵ�������ȣ�ԭ�Ӻ�������Ų�ʽΪ1s22s22p2����AΪ̼Ԫ�أ�C�Ļ�̬ԭ��2p�ܼ��ϵ�δ�ɶԵ�������Aԭ�ӵ���ͬ����Cԭ�Ӻ�������Ų�ʽΪ1s22s22p4����CΪOԪ�أ���ԭ��������֪BΪNԪ�أ�E��F��Cλ��ͬһ���壬F���ڵ�һ�������ڣ���EΪSԪ�أ�FΪSe��DΪ������������ԭ�Ӱ뾶��������Ԫ�أ�������A�壬ԭ����������OԪ����С����DΪNa��
��1��F ΪSe�����ڵ�������VIA�壬ԭ�ӻ�̬����Χ��������Ų�ʽΪ4s24p4��
�ʴ�Ϊ��4s24p4��
��2����C��N��O�γɵ�����OCN����CO2��Ϊ�ȵ����壬��OCN���ĽṹʽΪ��[N=C=O]����
�ʴ�Ϊ��[N=C=O]����
��3��Ԫ��̼�������γɵij���������ΪCS2����CO2�Ľṹ���ƣ���Ϊֱ���νṹ��̼ԭ�ӹ�����ӻ�����Ϊsp��
�ʴ�Ϊ��sp��
��4���ɾ����ṹ��֪�������д���[NO2]�ṹ��������ĿΪ1+8��![]() =2����������ԭ����ĿΪ8��
=2����������ԭ����ĿΪ8��![]() =2��
=2��
�ʸþ��廯ѧʽΪNaNO2��
�ʴ�Ϊ��NaNO2��
��5����A��N2O��CO2�ǵȵ����壬���߽ṹ���ƣ���N2OΪֱ���ͷ��ӣ���A��ȷ��
B��ͬһ����Ԫ�صĵ�һ����������ԭ����������������������ƣ����ڵ�ԭ��2p����ǰ����ȶ��ṹ����һ�����ܸ���ͬ��������Ԫ�صģ��������һ�����ܴ�С˳���ǣ�N��O��C����B����
C��CH2=CH��CHO������ÿ��̼ԭ�Ӿ��γ�����������û�й¶Ե��ӣ�������sp2�ӻ�����C��ȷ��
D��HCOOH���Ӽ����γ������CH3OCH3�����γɷ��Ӽ������������ͬѹǿ�£�HCOOH�е��CH3OCH3�ߣ���D����
��ѡ��AC��
��Fe2+���пչ����Ϊ�������ӣ�NO��H2O���й¶Ե��ӣ�Ϊ���壬
�ʴ�Ϊ��NO��H2O��Fe2+��
