题目内容
下列溶液中各微粒的浓度关系不正确的是
| A.0.1 mol/LCH3COOH溶液中:c(CH3COO-)+ c(CH3COOH)=0.1mol/L |
| B.NaHCO3溶液中:c(OH-) = c(H+) + c(H2CO3)-c(CO32—) |
| C.CH3COONa溶液中:c(Na+)> c(CH3COO-)> c(OH-)> c(H+) |
| D.Na2S溶液中:2 c(Na+)= c(S2—) + c(HS—)+ c(H2S) |
D
A项,考查物料守恒,CH3COOH部分电离产生CH3COO-和H+,醋酸根原子团守恒,得c(CH3COO-)+ c(CH3COOH)=0.1mol/L。B项,根据电荷守恒关系式C(Na+)+ c(H+)= 2 c(CO32—)+ c(HCO3—)+ c(OH-)和物料守恒关系式c(Na+)= c(CO32—)+ c(HCO3—)+ c(H2CO3),可计算得到c(OH-) = c(H+) + c(H2CO3)-c(CO32—)。C项,CH3COO-水解显碱性,所以c(Na+)> c(CH3COO-),c(OH-)> c(H+)。因为OH-是水解产生的,量很小,所以c(OH-)> c(H+)排在后边。D项,考查的物料守恒,c(Na+)="2" c(S)=2【c(S2—) + c(HS—)+ c(H2S)】

练习册系列答案
相关题目
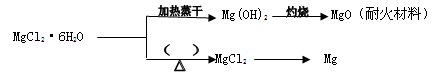
 Mg2++2OH-。向体系中加入(请填出两种不同类别的物质)_____________________________________________________ 有利于Mg(OH)2溶解。
Mg2++2OH-。向体系中加入(请填出两种不同类别的物质)_____________________________________________________ 有利于Mg(OH)2溶解。 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)