题目内容
【题目】H2S(常温下,氢硫酸的Ka1=5.7×10-8,Ka2=1.2×10-15)广泛存在于天然气、合成氨原料气、炼厂气等,生产中需脱硫处理。回答下列问题
(1)著名的 Vanviel反应为2nH2S+nCO2![]() (CH2O)n+nH2O+2nS↓,该反应能量转化形式是________。
(CH2O)n+nH2O+2nS↓,该反应能量转化形式是________。
(2)脱除天然气中H2S的工艺流程如下
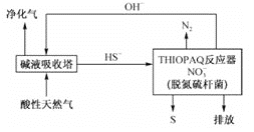
①常温下,“碱液吸收塔”中反应HS-+OH- ![]() S2-+H2O的平衡常数K=________。
S2-+H2O的平衡常数K=________。
②“ THIOPAO”反应器中,在脱氮硫杆菌的作用下,HS-氧化为S的离子方程式为________。
(3)铜(Ⅱ)沉淀及铜(Ⅱ)湿式氧化脱除硫化氢并可回收硫磺,主要步骤如下
(a)吸收H2S
(b)生成CuS沉淀
(c)CuCl2氧化CuS生成单质S和CuCl2-
(d)通O2再生
①常温下,沉淀反应之一:HS-+Cu2+![]() CuS+H+的平衡常数K= ________(已知常温下,KSP(CuS)=4×10-35)。
CuS+H+的平衡常数K= ________(已知常温下,KSP(CuS)=4×10-35)。
②CuCl2氧化CuS的离子方程式为 ________。
③通O2再生时的离子方程式为________ 。
【答案】光能转化为化学能 0.12 H2O+5HS-+2NO3-![]() 5S↓+N2↑+7OH- 3×1019 Cu2++4Cl-+CuS=S+2CuCl2- 4CuCl2-+O2+4H+=4Cu2++2H2O+8Cl-
5S↓+N2↑+7OH- 3×1019 Cu2++4Cl-+CuS=S+2CuCl2- 4CuCl2-+O2+4H+=4Cu2++2H2O+8Cl-
【解析】
(1)结合反应需要光照的条件进行分析;
(2)①根据反应平衡常数的表达式,结合Kw进行计算;
②根据图示信息确定反应物和生成物,结合得失电子守恒、电荷守恒和原子守恒书写反应的离子方程式;
(3)①结合平衡常数的表达式进行计算;
②CuCl2将CuS氧化,则生成S,同时Cu被还原为+1价,据此写出反应的离子方程式;
③O2具有氧化性,能将CuCl2-氧化成Cu2+, 据此写出反应的离子方程式。
(1)反应过程中需要光照条件,涉及光能,因此反应能量转化形式为光能转化为化学能;
(2)①该反应的平衡常数![]() , 又Kw=c(H+)×c(OH-),H2S的第二步电离平衡常数
, 又Kw=c(H+)×c(OH-),H2S的第二步电离平衡常数![]() , 因此该反应的平衡常数
, 因此该反应的平衡常数![]() ;
;
②由图可知,HS-氧化为S的过程中,NO3-参与反应,且生成了N2, 反应过程中S由-2价变为0,得到2个电子,N由+5价变为0价, 失去10个电子,根据得失电子守恒可得HS-和S的系数为5,NO3-的系数为2,N2的系数为1;结合电荷守恒可得,生成OH-的系数为7;结合氢原子守恒可得参与反应的H2O的系数为1;因此可得该反应的离子方程式为:H2O+5HS-+2NO3-![]() 5S↓+N2↑+7OH-;
5S↓+N2↑+7OH-;
(3)①该反应的平衡常数![]() , 而CuS的溶度积Ksp(CuS)=c(Cu2+)×c(S2-),H2S的第二步电离平衡常数
, 而CuS的溶度积Ksp(CuS)=c(Cu2+)×c(S2-),H2S的第二步电离平衡常数![]() , 因此该反应的平衡常数
, 因此该反应的平衡常数![]() ;
;
②CuCl2将CuS氧化,则生成S,同时Cu被还原为+1价,形成CuCl2-, 该反应的离子方程式为:Cu2++4Cl-+CuS=S+2CuCl2-;
③O2具有氧化性,能将CuCl2-氧化成Cu2+, 该反应的离子方程式为:4CuCl2-+O2+4H+=4Cu2++2H2O+8Cl-