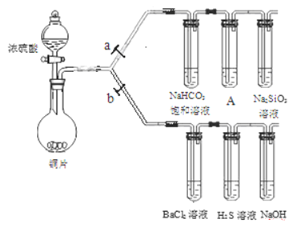
题目内容
【题目】Ⅰ物质的类别和核心元素的化合价是研究物质性质的两个重要角度。
下图所示是硫及其部分化合物的“价类二维图”, 根据图示回答下列问题:
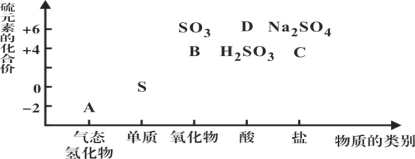
(1)图中A、B、C、D四种物质中,属于非电解质的是__________(用化学式表示)。
(2)足量B通入紫色石蕊溶液的现象是__________________________;用一个化学方程式说明B具有还原性_____________________________。
(3)C在反应中既可作氧化剂,又可作还原剂。当它作氧化剂时,理论上其可被还原为__________(填标号)。
A.Na2S B.S C.H2SO3 D.Na2SO4 E.H2SO4
(4)将A与SO2混合,可生成淡黄色固体。该反应的氧化剂与还原剂的物质的量之比为_____。
(5)D的浓溶液与铜单质在加热条件下可以发生化学反应,反应的化学方程式为__________________________________,反应中D显示酸性和______________。
Ⅱ.如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。

(1)硫酸具有A-D所示的性质,以下过程主要表现了浓硫酸的那些性质?
请将选项字母填在下列各小题的横线上:
A强酸性 B 吸水性 C 脱水性 D 强氧化性
①浓硫酸使木条变黑__________
②热的浓硫酸与铜片反应__________
(2)现用该浓硫酸配制100mL 1mol/L的稀硫酸。
可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④ 药匙;⑤量筒;⑥托盘天平。请回答下列问题:
配制稀硫酸时,上述仪器中不需要使用的有__________(选填序号),还缺少的仪器有__________(写仪器名称);
【答案】SO2 溶液变红色 2SO2+O2 ![]() 2SO3 AB 1:2 2H2SO4(浓)+Cu
2SO3 AB 1:2 2H2SO4(浓)+Cu![]() CuSO4+2H2O+SO2↑ 强氧化性或氧化性 C AD ②④⑥ 100mL容量瓶、 玻璃棒
CuSO4+2H2O+SO2↑ 强氧化性或氧化性 C AD ②④⑥ 100mL容量瓶、 玻璃棒
【解析】
I.根据元素的化合价与物质分类可知:A是H2S,B是SO2,C是Na2SO3,D是H2SO4;
(1)然后结合物质微粒的构成,判断其属性;
(2)SO2溶于水,发生反应产生亚硫酸H2SO3;硫元素化合价可从+4升到+6,故具有还原性;
(3) C是Na2SO3,作氧化剂时会得到电子,元素化合价降低;
(4)A是H2S,H2S与SO2反应,根据反应过程中电子得失数目相等分析;
(5)浓硫酸具有强氧化性,能将金属氧化为相应的盐,它本身被还原为SO2,根据其中S元素化合价分析其作用。
Ⅱ.(1)按具体的变化分析浓硫酸的性质;
(2)按配制一定物质的量浓度溶液的要求,选择合适的仪器;
I..(1) H2S的水溶液俗称氢硫酸,是二元弱酸;SO2溶于水,与水反应产生H2SO3,电离出阴阳离子可以导电,但SO2本身不能电离产生离子,属于非电解质;C是Na2SO3,是盐,属于电解质;D是H2SO4是酸,属于电解质,故上述四种物质中属于非电解质的是SO2;
答案为:SO2;
(2)B是SO2,易溶于水,与水发生反应产生亚硫酸H2SO3,H2SO3具有酸的通性,可以使紫色石蕊试液变为红色;
答案为:溶液变红色;
硫元素化合价可从+4升到+6,故具有还原性,二氧化硫能被多种氧化剂所氧化,例如2SO2+O2 ![]() 2SO3;
2SO3;
答案为:2SO2+O2 ![]() 2SO3;
2SO3;
(3)C是Na2SO3,S元素化合价为+4价,由于+4价处于S元素的最低-2价和最高+6价之间,所以它既有氧化性,也有还原性。当它作氧化剂时,获得电子,化合价降低;
A.Na2S中S为-2价,有可能被还原产生,A正确;
B.S化合价为0价,有可能被还原产生,B正确;
C.H2SO3中S价态没有变化,不可能发生氧化还原反应,C错误;
D.Na2SO4中S价态为+6价,化合价升高,失去电子,被氧化,Na2SO3作还原剂,不符合题意,D错误;
E.H2SO4中S价态为+6价,化合价升高,失去电子,被氧化,Na2SO3作还原剂,不符合题意,E错误;
答案为:AB;
(4) X为H2S,将X为H2S与SO2混合,可生成淡黄色固体,反应方程式为:2H2S+SO2=3S↓+2H2O,在反应中H2S中的硫元素化合价-2价变化S单质的0价,化合价升高,失去电子H2S作还原剂;SO2中+4价变化为S单质的0价,化合价降低,获得电子,SO2作氧化剂,则该反应的氧化剂与还原剂的物质的量之比为1:2;
答案为:1:2 ;
(5浓硫酸具有强的氧化性,在加热时遇Cu发生反应:2H2SO4(浓)+Cu![]() CuSO4+2H2O+SO2↑,S元素的化合价由反应前H2SO4中的+6价变为反应后SO2中+4价,化合价降低,,获得电子,H2SO4作氧化剂;还有一部分硫酸元素化合价没有发生变化,硫酸起酸的作用,与金属阳离子结合形成盐,所以在该反应中硫酸的作用是显示酸性和氧化性;
CuSO4+2H2O+SO2↑,S元素的化合价由反应前H2SO4中的+6价变为反应后SO2中+4价,化合价降低,,获得电子,H2SO4作氧化剂;还有一部分硫酸元素化合价没有发生变化,硫酸起酸的作用,与金属阳离子结合形成盐,所以在该反应中硫酸的作用是显示酸性和氧化性;
答案为:2H2SO4(浓)+Cu![]() CuSO4+2H2O+SO2↑;强氧化性或氧化性;
CuSO4+2H2O+SO2↑;强氧化性或氧化性;
II.(1)按具体变化分析①浓硫酸使木条变黑体现了浓硫酸的脱水性;②热的浓硫酸与铜片反应生成了硫酸铜和二氧化硫,硫酸部分被还原,体现了浓硫酸的强氧化性和强酸性;
答案为:C;AD;
(2)用浓硫酸配制100mL 1mol/L的稀硫酸,计算需要浓硫酸的体积,用量筒量取后在烧杯中稀释,用玻璃棒搅拌,冷却后沿玻璃棒注入100mL的容量瓶,加入水离刻度1-2cm处,改用胶头滴管滴定到终点,需要的仪器为:①胶头滴管、③烧杯、⑤量筒、玻璃棒, 100mL容量瓶,不需要的⑥托盘天平、④药匙、②烧瓶,还缺少的仪器有100mL容量瓶、玻璃棒;
答案为:②④⑥;玻璃棒、100mL容量瓶。

【题目】某校化学研究性学习小组设计实验验证NH3能还原CuO,并对还原产物进行探究。请回答下列问题:
Ⅰ.验证NH3能还原CuO
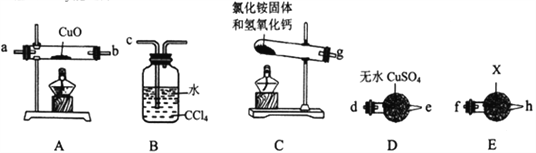
(1)试剂X为___________________________。
(2)请将提供的装置按合理顺序连接。g→_______________________。
(3)装置B的作用是_______________________。
(4)证明NH3能还原CuO的实验现象是_______________________。
II.探充还原产物的成分
【查阅资料】Cu2O粉末呈红色,在酸性溶液中不稳定:Cu2O+H2SO4(稀)=Cu+CuSO4+H2O。
【实验探究】
实验操作 | 实验现象 | 实验结论 |
取10.4g红色固体于烧杯中,加入足量稀硫酸,充分搅拌,静置 | 若无现象 | ①证明红色固体为_________。 |
若溶液变蓝 | ②证明红色固体肯定含有______,可能含有__________。 | |
取上述反应后的混合物过滤、洗涤、干燥、称重,得固体6.4g | ③经计算,红色固体的成分及其物质的量__________ |
【题目】某温度下,CO(g) + H2O (g)![]() CO2(g)+ H2(g)的平衡常数K=1。该温度下在体积均为1 L的甲、乙两个恒容密闭容器中,投入CO(g) 和 H2O (g)的起始浓度及5min时的浓度如下表所示。
CO2(g)+ H2(g)的平衡常数K=1。该温度下在体积均为1 L的甲、乙两个恒容密闭容器中,投入CO(g) 和 H2O (g)的起始浓度及5min时的浓度如下表所示。
甲 | 乙 | |||
起始浓度 | 5min时浓度 | 起始浓度 | 5min时浓度 | |
c(CO)/mol/L | 0.1 | 0.08 | 0.2 | x |
c(H2O)/mol/L | 0.1 | 0.08 | 0.2 | y |
下列判断不正确的是
A.x = y = 0.16
B.反应开始时,乙中反应速率比甲快
C.甲中0~5min的平均反应速率: v(CO)=0.004"mol/(L·min)
D.平衡时,乙中H2O的转化率是50%,c(CO)是甲中的2倍