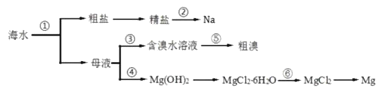
题目内容
【题目】(1)松油醇(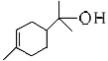 )的官能团的名称为_____________________。
)的官能团的名称为_____________________。
(2)苯与浓硫酸和浓硝酸的混合液共热的化学方程式为__________________________。
(3)1,3—丁二烯制备 1,4-二溴-2-丁烯的化学方程式为__________________________。
(4)燃烧法是测定有机化合物化学式的一种重要方法。在一定温度下取 0.1mol 某液态烃 A 在 O2 中完全燃烧,生成 CO2 和水蒸汽,将生成物依次通过浓硫酸和碱石灰,浓硫酸增重16.2g,碱石灰增重 35.2g。则烃 A 的分子式___________,含三个甲基的烃 A 同分异构体的数目为_________,烃 A 的一种同分异构体,其核磁共振氢谱只有一个吸收峰,写出该同分异构体的结构简式_________________。
【答案】碳碳双键、羟基 ![]() +HNO3
+HNO3 ![]()
![]() +H2O CH2=CH-CH=CH2+Br2→CH2Br-CH=CH-CH2Br C8H18 4 种 (CH3)3CC(CH3)3
+H2O CH2=CH-CH=CH2+Br2→CH2Br-CH=CH-CH2Br C8H18 4 种 (CH3)3CC(CH3)3
【解析】
(1)由松油醇的结构简式可知,官能团的名称为碳碳双键和羟基;
(2)苯与浓硫酸和浓硝酸的混合液共热,发生硝化反应,据此写化学方程式;
(3) 1,3—丁二烯制备 1,4-二溴-2-丁烯,通过1、4加成而得,据此写化学方程式;
(4)依据液态烃A的物质的量和生成水和二氧化碳的量计算A的分子式;依据限定条件判断同分异构体的数目和书写结构简式。
(1)由松油醇的结构简式可知,官能团的名称为碳碳双键和羟基,故答案为:碳碳双键、羟基;
(2)苯与浓硫酸和浓硝酸的混合液共热,发生硝化反应,其化学方程式为:![]() +HNO3
+HNO3![]()
![]() +H2O,故答案为:
+H2O,故答案为:![]() +HNO3
+HNO3![]()
![]() +H2O;
+H2O;
(3) 1,3—丁二烯制备 1,4-二溴-2-丁烯,通过1、4加成而得,化学方程式为:CH2=CH-CH=CH2+Br2→CH2Br-CH=CH-CH2Br,故答案为:CH2=CH-CH=CH2+Br2→CH2Br-CH=CH-CH2Br;
(4)由题意可知,0.1mol液态烃A燃烧生成水的物质的量为![]() =0.9mol,二氧化碳的物质的量为
=0.9mol,二氧化碳的物质的量为![]() =0.8mol,则有机物与分子中碳原子和氢原子的个数比为0.1mol:0.8mol:0.9mol×2=1:8:18,烃的分子式为C8H18;C8H18含三个甲基的同分异构体可能为主链C原子有7,则支链对应的C原子有1个,符合条件同分异构体有三种分别为CH3CH(CH3)CH2CH2CH2CH2CH3,CH3CH2CH(CH3)CH2CH2CH2CH3,CH3CH2CH2CH(CH3)CH2CH2CH3,主链C原子有6个,则支链对应的C原子有2个,符合条件同分异构体有一种为CH3CH2CH(C2H5)CH2CH2CH3,共有4种;分子中只有一种H原子,C8H18是烷烃,所以H原子一定位于甲基上,所以甲基数目为6,剩余的2个C原子通过单键连接,每个C原子连接3个甲基,结构简式为(CH3)3CC(CH3)3, 故答案为:C8H18;4;(CH3)3CC(CH3)3。
=0.8mol,则有机物与分子中碳原子和氢原子的个数比为0.1mol:0.8mol:0.9mol×2=1:8:18,烃的分子式为C8H18;C8H18含三个甲基的同分异构体可能为主链C原子有7,则支链对应的C原子有1个,符合条件同分异构体有三种分别为CH3CH(CH3)CH2CH2CH2CH2CH3,CH3CH2CH(CH3)CH2CH2CH2CH3,CH3CH2CH2CH(CH3)CH2CH2CH3,主链C原子有6个,则支链对应的C原子有2个,符合条件同分异构体有一种为CH3CH2CH(C2H5)CH2CH2CH3,共有4种;分子中只有一种H原子,C8H18是烷烃,所以H原子一定位于甲基上,所以甲基数目为6,剩余的2个C原子通过单键连接,每个C原子连接3个甲基,结构简式为(CH3)3CC(CH3)3, 故答案为:C8H18;4;(CH3)3CC(CH3)3。

【题目】氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。某实验小组以H2O2分解为例,探究浓度、催化剂、温度对反应速率的影响。在常温下按照下表所示的方案完成实验。
实验编号 | 温度(℃) | 反应物 | 催化剂 |
① | 20 | 25 mL 3% H2O2溶液 | 无 |
② | 20 | 25 mL 5% H2O2溶液 | 无 |
③ | 20 | 25 mL 5% H2O2溶液 | 0.1g MnO2 |
④ | 20 | 25 mL 5% H2O2溶液 | 1~2滴1mol/L FeCl3溶液 |
⑤ | 30 | 25 mL 5% H2O2溶液 | 0.1g MnO2 |
(1)实验①和②的目的是____________________________。同学甲在进行实验时并没有观察到明显现象。资料显示,通常条件下过氧化氢稳定,不易分解。为了达到实验目的,可采取的改进方法是__________(写出一种即可)。
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化如甲图所示。分析该图能得出的结论是__________________________,__________________________;

(3)写出实验③中H2O2分解的化学方程式:______________________________;
(4)同学乙设计了乙图所示的实验装置对过氧化氢的分解速率进行定量分析。以生成10mL气体为准,其他影响实验的因素均已忽略。图中仪器A的名称为__________,实验中需要测量的数据是______________。
(5)某反应在体积为2L的恒容密闭的绝热容器中进行,各物质的量随时间的变化情况如图所示(已知X、Y、Z均为气体).

①该反应的化学方程式为______.
②反应开始至2分钟时,Y的平均反应速率为______.
③能说明该反应已达到平衡状态的是______
A.υ(X)=3υ(Y)B.容器内气体密度不变
C.υ逆(Z)=2υ正(Y)D.各组分的物质的量相等
E.混合气体的平均相对分子质量不再改变的状态
④由图求得平衡时X的转化率为______.