题目内容
【题目】氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。某实验小组以H2O2分解为例,探究浓度、催化剂、温度对反应速率的影响。在常温下按照下表所示的方案完成实验。
实验编号 | 温度(℃) | 反应物 | 催化剂 |
① | 20 | 25 mL 3% H2O2溶液 | 无 |
② | 20 | 25 mL 5% H2O2溶液 | 无 |
③ | 20 | 25 mL 5% H2O2溶液 | 0.1g MnO2 |
④ | 20 | 25 mL 5% H2O2溶液 | 1~2滴1mol/L FeCl3溶液 |
⑤ | 30 | 25 mL 5% H2O2溶液 | 0.1g MnO2 |
(1)实验①和②的目的是____________________________。同学甲在进行实验时并没有观察到明显现象。资料显示,通常条件下过氧化氢稳定,不易分解。为了达到实验目的,可采取的改进方法是__________(写出一种即可)。
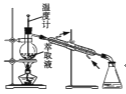
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化如甲图所示。分析该图能得出的结论是__________________________,__________________________;
(3)写出实验③中H2O2分解的化学方程式:______________________________;
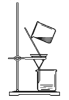
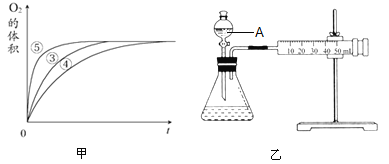
(4)同学乙设计了乙图所示的实验装置对过氧化氢的分解速率进行定量分析。以生成10mL气体为准,其他影响实验的因素均已忽略。图中仪器A的名称为__________,实验中需要测量的数据是______________。
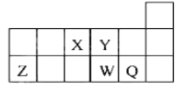
(5)某反应在体积为2L的恒容密闭的绝热容器中进行,各物质的量随时间的变化情况如图所示(已知X、Y、Z均为气体).
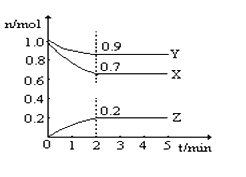
①该反应的化学方程式为______.
②反应开始至2分钟时,Y的平均反应速率为______.
③能说明该反应已达到平衡状态的是______
A.υ(X)=3υ(Y)B.容器内气体密度不变
C.υ逆(Z)=2υ正(Y)D.各组分的物质的量相等
E.混合气体的平均相对分子质量不再改变的状态
④由图求得平衡时X的转化率为______.
【答案】探究浓度对反应速率的影响 向反应物中加入等量同种催化剂(或升高相同温度) 升高温度,反应速率加快 MnO2对过氧化氢分解的催化效果更好 2H2O2 ![]() 2H2O +O2 分液漏斗 产生10mL气体所需的时间 Y+3X 2Z 0.025mol/(L·min) CE 30%
2H2O +O2 分液漏斗 产生10mL气体所需的时间 Y+3X 2Z 0.025mol/(L·min) CE 30%
【解析】
(1)实验①和②的浓度不同;现象不明显,根据题意,需要尽快反应速率;
(2)由图可知,⑤的反应速率最大,④的反应速率最小,结合反应的条件分析解答;
(3)H2O2在二氧化锰作用下生成水和氧气;
(4)A仪器名称是分液漏斗;该反应是通过反应速率分析的,根据v=![]() 分析;
分析;
(5)①由图可知,X 、Y的物质的量减小, Z的物质的量增加,且2min时物质的量不变,判断出X、Y、Z的物质的量的变化量之比,物质的量的变化量之比等于化学计量数之比,据此书写反应的方程式;
②结合v=![]() 计算;
计算;
③可逆反应达到平衡状态时,正、逆反应速率相等,各组分浓度不再变化,据此分析判断;
④根据X达到平衡时已转化的物质的量与起始的物质的量之比,可求得平衡时X的转化率。
(1)实验①和②的浓度不同,则该实验的目的为探究浓度对化学反应速率的影响;同学甲在进行实验时并没有观察到明显现象。资料显示,通常条件下过氧化氢稳定,不易分解。为了便于比较,需要加快反应速率,可以向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中,升高相同温度),故答案为:探究浓度对反应速率的影响;向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中,升高相同温度);
(2)由图可知,③、⑤中⑤的反应速率大,说明升高温度,反应速率加快;③、④中④的反应速率小,说明MnO2对过氧化氢分解的催化效果更好,故答案为:升高温度,反应速率加快;MnO2对过氧化氢分解的催化效果更好;
(3)H2O2在二氧化锰作用下发生反应的化学反应方程式为:2H2O2 ![]() 2H2O+O2↑,故答案为:2H2O2
2H2O+O2↑,故答案为:2H2O2 ![]() 2H2O+O2↑;
2H2O+O2↑;
(4)结合乙图装置,图中仪器A为分液漏斗;反应是通过反应速率分析的,根据v=![]() ,所以实验中需要测量的数据是时间(或收集一定体积的气体所需要的时间),故答案为:分液漏斗;产生10mL气体所需的时间;
,所以实验中需要测量的数据是时间(或收集一定体积的气体所需要的时间),故答案为:分液漏斗;产生10mL气体所需的时间;
(5)①由图可知,X、Y的物质的量减小,Z的物质的量增加,且2min时物质的量不变,说明该反应为可逆反应,X、Y、Z的物质的量的变化量之比为(1.0-0.7)∶(1.0-0.9)∶(0.2-0)=3∶1∶2,物质的量的变化量之比等于化学计量数之比,则反应为Y+3X 2Z,故答案为:Y+3X 2Z;
②2分钟内,Y的平均反应速率为![]() =0.025mol/(L·min),故答案为:0.025mol/(L·min);
=0.025mol/(L·min),故答案为:0.025mol/(L·min);
③A.根据方程式Y+3X 2Z,如何时候都存在υ(X)=3υ(Y),不能说明正反应和逆反应的关系,无法判断反应是否达到平衡,故A错误;B.容器的体积以及气体的质量不变,无论是否达到平衡状态,容器内气体密度都不变,不能说明达到平衡,故B错误;C.根据方程式Y+3X 2Z,当υ逆(Z)=2υ正(Y)时,正、逆反应速率相等,说明反应已达平衡状态了,故C正确;D.容器内各物质的物质的量相等,不能说明各组分的浓度不再变化,无法判断是否达到平衡状态,故D错误;E.气体的质量不变,但反应前后气体的物质的量不等,则混合气体的平均相对分子质量为变量,当混合气体的平均相对分子质量不再改变的状态,说明达到平衡状态,故E正确;故答案为:CE;
④由图象可知:达平衡时X的浓度变化为:△n(X)=1.0mol-0.7mol=0.3mol,所以X的转化率为:![]() ×100%=30%,故答案为:30%。
×100%=30%,故答案为:30%。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案