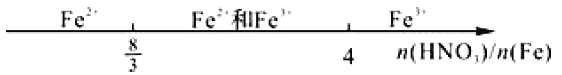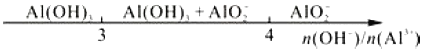题目内容
【题目】溶液的酸碱性可用酸度(AG)表示,![]() 。室温下,将0.0100molL-l盐酸逐滴滴入20.0mL 0.0100molL-l氨水中,溶液的AG变化如图所示。下列说法正确的是( )
。室温下,将0.0100molL-l盐酸逐滴滴入20.0mL 0.0100molL-l氨水中,溶液的AG变化如图所示。下列说法正确的是( )
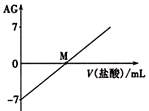
A. M点以后NH4+的水解程度逐渐增大
B. 室温下,0. 0100molL-l盐酸的AG =12
C. M点加入盐酸的体积大于20.0 mL
D. M点时溶液中:c(NH4+) =c(Cl-)
【答案】D
【解析】A.M点后,若盐酸过量,HCl电离出的氢离子抑制了铵根离子的水解,A错误;B.室温下,0.01 molL-l盐酸中氢离子浓度为0.01mol/L,氢氧根离子浓度为10-12mol/L,该盐酸的AG=0.01/1012=lg10,B错误;C.M点时c(H+)=c(OH-),溶液呈中性,当加入盐酸的体积为20.00 mL时,溶质为氯化铵,溶液为酸性,若为中性,则加入盐酸体积稍小于20.00mL,C错误;D.根据图象可知,M点的AG=lgc(H+)/c(OH)=0,则c(H+)=c(OH-),根据电荷守恒可知c(NH4+)=c(Cl-),D正确;答案选D。

 阅读快车系列答案
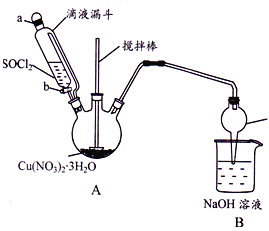
阅读快车系列答案【题目】某研究小组设计如图所示实验装置(夹持及控温装置省略),用Cu(NO3)2 3H2O晶体和SOCl2制备少量无水Cu(NO3)2。已知SOC12熔点-l05℃、沸点76℃、遇水剧烈水解生成两种酸性气体。
 .
.
(1)①仪器c的名称是_________________。
②向三颈烧瓶中缓慢滴加SOC12时,需打开活塞_________(选填“a”、“b”或“a 和 b”)。
(2)装置A中Cu(NO3)2 3H2O和SOC12发生反应的化学方程式是________________。
(3)装置B的作用是________________。
(4)实验室以含铁的铜屑为原料制备Cu(NO3)2 3H2O的实验方案如下:
![]()
己知几种离子生成氢氧化物沉淀的pH如下表
开始沉淀的pH | 沉淀完全的pH | |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Cu2+ | 4.2 | 6.7 |
①步骤I中所用稀HNO3稍过量的目的是_____________。
②请补充完整由溶液I制备Cu(NO3)2 3H2O晶体的实验方案:
向溶液I中加入__________,冰水洗涤得到Cu(NO3)2 3H2O晶体。