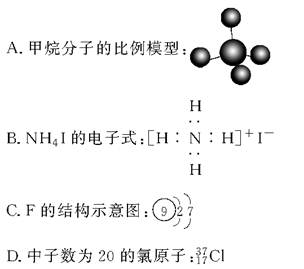
题目内容
短周期元素A、B、C、D原子序数依次增大,且C元素最高价氧化物对应的水化物能电离出电子数相等的阴、阳离子。A、C位于同一主族,A为非金属元素,B的最外层电子数是次外层电子数的3倍,B、C的最外层电子数之和与D的最外层电子数相等。E单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏。请回答下列问题:
(1)C的最高价氧化物对应水化物的化学式为 ,
其中含有的化学键类型为 。
(2)由上述A、B、C、D四种元素中的三种组成某种盐,水溶液显碱性,是家用消毒剂的主要成分。将该盐溶液滴入KI淀粉溶液中,溶液变为蓝色,则反应的离子方程式为 ________________________________ 。
(3)E元素与D元素可形成ED2和ED3两种化合物,下列说法正确的是 (填序号)。
①保存ED2溶液时,需向溶液中加入少量E单质
②ED2只能通过置换反应生成,ED3只能通过化合反应生成
③铜片、碳棒和ED3溶液组成原电池,电子由铜片沿导线流向碳棒
④向淀粉碘化钾溶液和苯酚溶液中分别滴加几滴ED3的浓溶液,原无色溶液都变成紫色
(1)C的最高价氧化物对应水化物的化学式为 ,
其中含有的化学键类型为 。
(2)由上述A、B、C、D四种元素中的三种组成某种盐,水溶液显碱性,是家用消毒剂的主要成分。将该盐溶液滴入KI淀粉溶液中,溶液变为蓝色,则反应的离子方程式为 ________________________________ 。
(3)E元素与D元素可形成ED2和ED3两种化合物,下列说法正确的是 (填序号)。
①保存ED2溶液时,需向溶液中加入少量E单质
②ED2只能通过置换反应生成,ED3只能通过化合反应生成
③铜片、碳棒和ED3溶液组成原电池,电子由铜片沿导线流向碳棒
④向淀粉碘化钾溶液和苯酚溶液中分别滴加几滴ED3的浓溶液,原无色溶液都变成紫色
(1)NaOH 离子键和共价键
(2)2I-+ClO-+H2O=I2+Cl-+2OH-
(3)①③
(2)2I-+ClO-+H2O=I2+Cl-+2OH-
(3)①③
解答本题时应注意以下两点:
(1)C为短周期元素,且C的最高价氧化物的水化物能电离出电子数相等的阴、阳离子,确定C元素;
(2)由B的核外电子排布特点,最外层电子数是次外层电子数的3倍,可确定B元素。
C的最高价氧化物对应的水化物能够电离出电子数相等的阴、阳离子,C为钠元素;A、C位于同一主族,且A为非金属元素,A为氢元素;B原子最外层电子数是次外层电子数的3倍,B为氧元素;B、C的最外层电子数之和为1+6=7,D元素原子最外层有7个电子,D为Cl;E为常见金属且在潮湿空气中容易被腐蚀,E为Fe。
(1)NaOH中存在的化学键为离子键和共价键。
(2)H、O、Na、Cl四种元素中的三种形成的盐,是家用消毒剂的主要成分,溶液显碱性,该盐为NaClO,与KI反应的离子方程式为2I-+ ClO-+ H2O=I2+Cl-+2OH-。
(3)保存FeCl2溶液加入少量铁粉的原因是防止Fe2+被氧化,①对;FeCl2可以通过置换反应制得Fe+2HCl=FeCl2+H2↑,也可以通过化合反应制得Fe+2FeCl3=3FeCl2,②错;Cu、碳棒、FeCl3溶液形成原电池,碳棒作正极,电子由铜片流向碳棒,③对;淀粉碘化钾溶液中加入FeCl3浓溶液,溶液显蓝色,苯酚溶液中加入FeCl3溶液,溶液显紫色,④错。
(1)C为短周期元素,且C的最高价氧化物的水化物能电离出电子数相等的阴、阳离子,确定C元素;
(2)由B的核外电子排布特点,最外层电子数是次外层电子数的3倍,可确定B元素。
C的最高价氧化物对应的水化物能够电离出电子数相等的阴、阳离子,C为钠元素;A、C位于同一主族,且A为非金属元素,A为氢元素;B原子最外层电子数是次外层电子数的3倍,B为氧元素;B、C的最外层电子数之和为1+6=7,D元素原子最外层有7个电子,D为Cl;E为常见金属且在潮湿空气中容易被腐蚀,E为Fe。
(1)NaOH中存在的化学键为离子键和共价键。
(2)H、O、Na、Cl四种元素中的三种形成的盐,是家用消毒剂的主要成分,溶液显碱性,该盐为NaClO,与KI反应的离子方程式为2I-+ ClO-+ H2O=I2+Cl-+2OH-。
(3)保存FeCl2溶液加入少量铁粉的原因是防止Fe2+被氧化,①对;FeCl2可以通过置换反应制得Fe+2HCl=FeCl2+H2↑,也可以通过化合反应制得Fe+2FeCl3=3FeCl2,②错;Cu、碳棒、FeCl3溶液形成原电池,碳棒作正极,电子由铜片流向碳棒,③对;淀粉碘化钾溶液中加入FeCl3浓溶液,溶液显蓝色,苯酚溶液中加入FeCl3溶液,溶液显紫色,④错。

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
 A+N2↑+3CO2↑(已配平)。
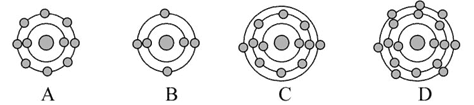
A+N2↑+3CO2↑(已配平)。 ,下列原子中,与氟元素原子的化学性质相似的是( )
,下列原子中,与氟元素原子的化学性质相似的是( )