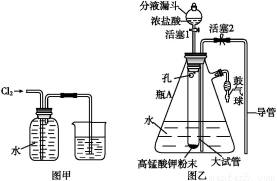
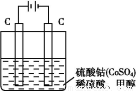
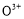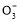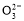题目内容
用惰性电极电解NaCl与NaHCO3的混合溶液,测得溶液的pH变化如图所示。
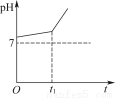
(1)在0→t1时间内,两个电极上的电极反应式为:
阳极:________________________________________________________________________;
阴极:________________________________________________________________________。
(2)用离子方程式表示0→t1时间内,溶液pH升高比较缓慢的原因:____________________________________________________________________________。
(1)2Cl--2e-=Cl2↑ 2H++2e-=H2↑
(2)HCO3-+OH-=CO32-+H2O
【解析】由于HCO3-、Na+均不易放电,故阳极反应式为2Cl--2e-=Cl2↑;阴极反应式为2H++2e-=H2↑。随着反应的进行c(OH-)增大,HCO3-+OH-=CO32-+H2O,故而开始pH变化缓慢,当HCO3-完全反应后,pH增幅加大。

 名校课堂系列答案
名校课堂系列答案已知25 ℃时有关弱酸的电离平衡常数如下表:
弱酸的化学式 | CH3COOH | HCN | H2CO3 |
电离平衡常数(25 ℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
则下列有关说法正确的是( )
A.等浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于b
C.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HC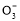 )+2c(C
)+2c(C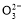 )
)