题目内容
【题目】锰酸锂(LiMn2O4)是最早制得的具有三维锂离子通道的正极材料。以MnSO4和LiFePO4为原料制备锰酸锂的流程如图:
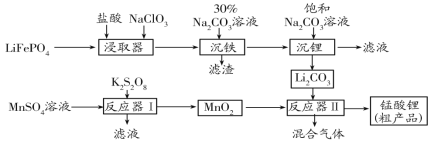
请回答下列问题:
(1)“沉铁”过程所得滤渣为白色固体,其主要成分是___。
(2)K2S2O8中S的化合价为+6价,则S2O82-中含过氧键的数目为__,反应器Ⅰ中发生反应的离子方程式__。
(3)反应器Ⅱ中反应温度为600~750℃。升温到515℃时,开始有CO2产生,比碳酸锂的分解温度(723℃)低得多,可能的原因是___。
(4)制得的锰酸锂粗产品中混有LiMnO2,写出在高温条件下反应产生LiMnO2的化学方程式___;称取一定量的锰酸锂粗产品于锥形瓶中,加入稀硫酸充分溶解,滴入含0.14molNa2C2O4的标准溶液时恰好完全反应,同时生成0.19molMn2+,则锰酸锂粗产品中LiMn2O4物质的量分数为___。 (MnO2-、Mn2O4-被还为Mn2+)
【答案】FePO4 1 Mn2++S2O82-+2H2O=MnO2↓+4H++2SO42- MnO2作催化剂,降低了碳酸锂分解反应的活化能,加快碳酸锂分解 4MnO2+2Li2CO3![]() 4LiMnO2+2CO2↑+O2↑ 90%
4LiMnO2+2CO2↑+O2↑ 90%
【解析】
LiFePO4加入盐酸和氯酸钠浸取,浸取过程中亚铁离子被氧化成铁离子,之后加入碳酸钠溶液调节pH,使Fe3+沉淀,得到的滤渣为白色固体,说明不是氢氧化铁沉淀,根据元素守恒可知该沉淀应为FePO4,之后再加入饱和的碳酸钠溶液得到碳酸锂沉淀;MnSO4与K2S2O8反应,Mn2+被氧化成MnO2生成沉淀析出,之后将MnO2与Li2CO3混合反应得到锰酸锂。
(1)该滤渣为白色固体,说明不是氢氧化铁,根据元素守恒以及溶解度的大小关系,该沉淀应为FePO4;
(2)设S2O82-中含负一价的氧原子数目为x,则有(+6)×2+(-2)(8-x)+(-1)x=-2解得x=2,两个负一价氧原子间有一个过氧键,故过氧键数目为1;反应其I中Mn2+被氧化成MnO2,S2O82-中-1价的氧被还原成-2价,结合电子守恒和元素守恒可知方程式应为:Mn2++S2O82-+2H2O=MnO2↓+4H++2SO42-;
(3)MnO2作催化剂,降低了碳酸锂分解反应的活化能,加快碳酸锂分解;
(4)反应物为MnO2和Li2CO3,产物有LiMnO2,说明该过程中Mn元素被还原,C元素已是最高价,不能被氧化,根据元素价态变化规律可知O元素被氧化成氧气,结合电子守恒和元素守恒可知方程式应为:4MnO2+2Li2CO3![]() 4LiMnO2+2CO2↑+O2↑;设粗产品中LiMnO2的物质的量为x,LiMn2O4的物质的量为y,根据元素守恒有x+2y=0.19mol;根据电子守恒有x+
4LiMnO2+2CO2↑+O2↑;设粗产品中LiMnO2的物质的量为x,LiMn2O4的物质的量为y,根据元素守恒有x+2y=0.19mol;根据电子守恒有x+![]() y×2=0.14mol×2,联立解得y=0.09mol,x=0.01mol,则锰酸锂粗产品中LiMn2O4物质的量分数为
y×2=0.14mol×2,联立解得y=0.09mol,x=0.01mol,则锰酸锂粗产品中LiMn2O4物质的量分数为![]() =90%。
=90%。

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案【题目】目前工业上有一种方法是用CO2生产燃料甲醇(CH3OH)。反应的化学方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),该反应的能量变化如图所示:
CH3OH(g)+H2O(g),该反应的能量变化如图所示:
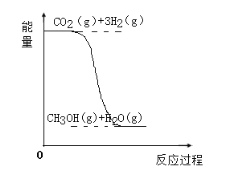
(1)该反应是__反应(填“吸热”或“放热”),判断的理由是___。
(2)某温度时,在体积为2L的密闭容器中,充入1molCO2和3molH2,测得CO2的物质的量随时间变化如下表所示:
时间/min | 0 | 2 | 5 | 10 | 15 |
n(CO2)/mol | 1 | 0.85 | 0.7 | 0.25 | 0.25 |
从反应开始到5min末,用CO2表示的该反应的平均速率为__;反应达平衡时,H2的转化率为__;要提高此反应的速率,可以采取___措施(填写2条)。
(3)若维持(2)的条件不变,能说明该反应已达平衡状态的是__(填序号)。
A.v生成(CH3OH)=v消耗(CO2)
B.CO2、H2、CH3OH、H2O浓度相等的状态
C.CO2、H2、CH3OH、H2O总物质的量保持不变的状态
D.CO2的转化率保持不变的状态
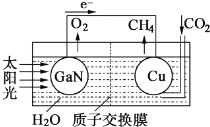
(4)依据原电池原理,将甲醇设计成燃料电池如图:
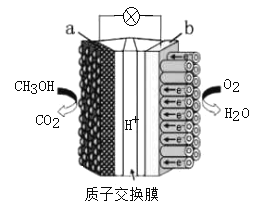
则a为__极(填“正”或“负”);H+从__极区向__极区迁移(用图中字母填);b极上O2发生反应电极反应式为:__。