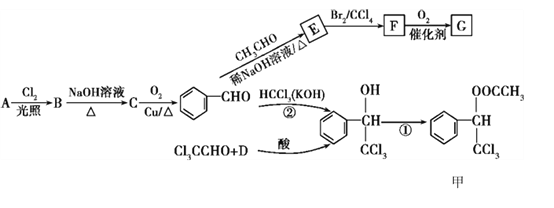
题目内容
【题目】(1)标准状况下,用一定量的水吸收氨气后制得浓度为12.0mol·L-1、密度为0.915g·cm-3的氨水。试计算1体积水吸收____________体积的氨气可制得上述氨水。(水的密度以1.00g·cm-3计)
(2) 硫铁矿高温下空气氧化产生二氧化硫:4FeS2+11O2 = 8SO2+2Fe2O3设空气中N2、O2的含量分别为0.800和0.200(体积分数),试完成下列各题:
①1.00mol FeS2完全氧化,需要空气的体积(标准状况)为________L
②55L空气和足量FeS2完全反应后,气体体积(同温同压)变为________L
③设FeS2氧化产生的气体混合物为100L,其中O2为aL,SO2为bL。写出a和b的关系式:________________________________
【答案】378 308 52 13b=200-10a
【解析】
(1)假设溶液体积为1.00L,根据n(NH3)=c(NH3)×V,求出1L溶液中所含氨气的物质的量,求出标准状况下氨气的体积;根据水的质量=氨水的质量-氨气的质量,求出水的质量,进而求出水的体积;由V(NH3/V(H2O)求出1体积水所吸收氨气的体积。
(2)①根据方程式计算需要氧气的物质的量,再根据V=nVm氧气的体积,根据空气中氧气的体积分数计算需要空气的体积;
②计算空气中氧气的体积,利用差量法计算反应后气体体积变化,据此解答;
③根据二氧化硫的体积计算参加反应氧气体积,表示出氮气的体积,利用氮气体积不变列关系式解答;
(1)假设溶液体积为1.00L,1.00L该氨水含氨的物质的量为1.00L×12.0mol/L=12.0mol,V(NH3)=12.0mol×22.4L/mol=268.8L;1.00L该氨水中含水的质量m(H2O)=1![]() 12
12![]() =711g,V(H2O)=
=711g,V(H2O)=![]() L=0.711L;标准状况下,1体积水吸收氨气的体积为V(H2)=(268L/0.711L)
L=0.711L;标准状况下,1体积水吸收氨气的体积为V(H2)=(268L/0.711L)![]() 1L=378L,本题答案为:378
1L=378L,本题答案为:378
(2)①根据方程式4FeS2+11O2=8SO2+2Fe2O3可以知道,1.00molFeS2完全氧化需要氧气物质的量=11/4mol,故需要空气的体积=![]() =308L,因此,本题答案为:308;
=308L,因此,本题答案为:308;
②55L空气中氧气的体积=55L×0.2=11L,则:4FeS2+11O2=8SO2+2Fe2O3
11 8 △V = 11-8=3
故反应后气体的体积为55L-3L=52L,因此,本题正确答案是:52;
③4FeS2+11O2=8SO2+2Fe2O3
11 8
( 11/8 )b b
反应前后氮气的体积不变,则:(aL+![]() bL)
bL)![]() 4=100L-aL-bL,整理可得:13b=200-10a,因此,本题答案是:13b=200-10a。
4=100L-aL-bL,整理可得:13b=200-10a,因此,本题答案是:13b=200-10a。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案