题目内容
测定生成SO3的转化率可以用下图装置,装置中烧瓶内发生的化学反应方程式为:Na2SO3(s)+H2SO4(85%)=Na2SO4+H2O+SO2↑(已知SO3的熔点是16.8oC,沸点是44.8oC)
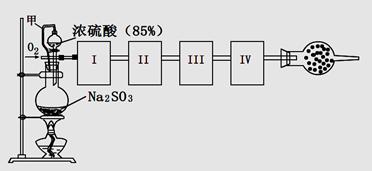
(1)装置中甲管的作用是__________________。
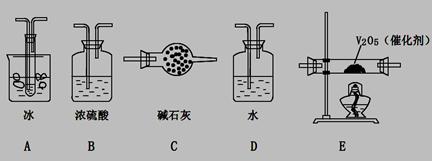
(2)根据实验需要,应该在I、II、III、IV处连接合适的装置,请从下图A?E装置中选择最适合装置并将其序号填至下面的空格中,每个装置不重复使用。
I、 II、III、IV处连接的装置分别是 。
(3)为使SO2有较高的转化率,实验中加热催化剂与滴加浓硫酸的顺序中,应采取的操作是____________ ,若用大火加热烧瓶时,SO2的转化率会____________ (填“升高”、“不变”或“降低”)。
(4)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象不明显,但又不存在气密性问题,请你推测可能的原因(可以不填满)①原因:______ ②原因 :______ ③原因:______
(5)将SO2通入含1mol氯酸的溶液中,可生成一种强酸和一种氧化物,并有6.02×1023个电子转移,则该反应的化学方程式为
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置IV增重了 mg,则实验中SO2的转化率为 。(用含m、n的代数式填写)

(1)装置中甲管的作用是__________________。
(2)根据实验需要,应该在I、II、III、IV处连接合适的装置,请从下图A?E装置中选择最适合装置并将其序号填至下面的空格中,每个装置不重复使用。
I、 II、III、IV处连接的装置分别是 。

(3)为使SO2有较高的转化率,实验中加热催化剂与滴加浓硫酸的顺序中,应采取的操作是____________ ,若用大火加热烧瓶时,SO2的转化率会____________ (填“升高”、“不变”或“降低”)。
(4)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象不明显,但又不存在气密性问题,请你推测可能的原因(可以不填满)①原因:______ ②原因 :______ ③原因:______
(5)将SO2通入含1mol氯酸的溶液中,可生成一种强酸和一种氧化物,并有6.02×1023个电子转移,则该反应的化学方程式为
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置IV增重了 mg,则实验中SO2的转化率为 。(用含m、n的代数式填写)
(1)让硫酸顺利流下。(意思对,或答保持分液漏斗和烧瓶内压强相等也给分)
(2)BEAC
(3)先加热催化剂再加浓硫酸 降低
(4)①Na2SO3变质( 分),②浓硫酸的浓度不够(其他合理答案均给分)
(5)SO2+2HClO3=H2SO4+2ClO2
(6)(64n-m)/64n×100%(其他合理答案均给分)
(2)BEAC
(3)先加热催化剂再加浓硫酸 降低
(4)①Na2SO3变质( 分),②浓硫酸的浓度不够(其他合理答案均给分)
(5)SO2+2HClO3=H2SO4+2ClO2
(6)(64n-m)/64n×100%(其他合理答案均给分)
试题分析:(1)橡胶管的作用是平衡压强,使液体顺利流下。(2)生成的二氧化硫气体通过浓硫酸干燥后通过五氧化二矾催化剂发生反应,然后将混合气体通过冰冷凝三氧化硫,二氧化硫被碱石灰吸收。(3)为提高二氧化硫转化率,催化剂应预先加热,使生成的二氧化硫立即与氧气发生反应;若大火加热,二氧化硫反应不完全,转化率低。(4)亚硫酸钠与85%硫酸反应生成二氧化硫,随着反应进行,硫酸浓度变稀,导致后续现象不明显;也可能亚硫酸钠部分变质为硫酸钠导致二氧化硫气体产生缓慢。(5)二氧化硫通过含1molHClO3溶液,转移1mol电子,说明HClO3还原产物为ClO2,所以二氧化硫被氧化为硫酸。(6)nmolNa2SO3与足量浓硫酸生成nmolSO2,装置IV增重mg说明未反应的SO2为m/64mol,所以二氧化硫转化率为(64n-m)/64n。
点评:本题实验原理是二氧化硫与氧气催化氧化生成三氧化硫,二氧化硫由亚硫酸钠与浓硫酸反应得到,最好再增加一个提供氧气的装置更好,因系统中氧气毕竟有限。

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
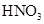 和
和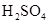 物质的量浓度分别为
物质的量浓度分别为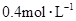 和
和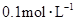 ,向该溶液中加入1.92g铜粉,加热,待充分反应后,所得溶液中
,向该溶液中加入1.92g铜粉,加热,待充分反应后,所得溶液中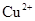 物质的量浓度(
物质的量浓度(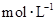 )为
)为 H2SO4
H2SO4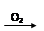 SO2
SO2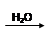 H2SO4
H2SO4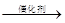 C+NO2
C+NO2