题目内容
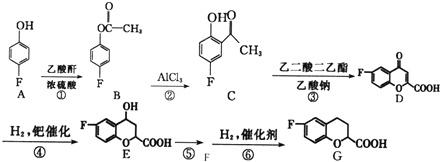
【题目】现有HA、HB和H2C三种酸。室温下用0.1mol·L-1NaOH溶液分别滴定20.00 mL浓度均为0.1mol·L-1的HA、HB两种酸的溶液,滴定过程中溶液的pH随滴入的NaOH 溶液体积的变化如图所示。
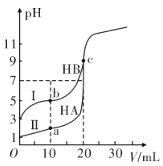
(1)a点时的溶液中由水电离出的c(H+)=________mol·L-1,Ka(HB)=________。
(2)与曲线I 上的c点对应的溶液中各离子浓度由大到小的顺序为________;b点对应的溶液中c(HB)____c(B-)(填“>”“<”或“=”)。
(3)已知常温下向0.1mol·L-1的NaHC 溶液中滴入几滴石蕊试液后溶液变成红色。
①若测得此溶液的pH=1,则NaHC的电离方程式为_______________。
②若在此溶液中能检测到H2C 分子,则此溶液中c(C2-)________c(H2C)(填“>”“<”或“=”)。
③若H2C的一级电离为H2C=H++ HC-,常温下0.1mol·L-1H2C溶液中的c(H+ )=0.11mol·L-1,则0.1mol·L-1NaHC溶液中的c(H+)________0.01mol·L-1(填“>”“<”或“=”)。
【答案】 3×10-13 1×10-5 c(Na+)>c(B-)>c(OH-)>c(H+) < NAHC=Na++H++C2- > >
【解析】(1)由图中曲线I可知,浓度0.1mol·L-1的HA酸溶液的pH=1,说明HA是强酸,完全电离,a点时加入10mL氢氧化钠溶液,则溶液中酸过量, ![]() ,酸抑制水的电离,溶液中由水电离出的c(H+)=
,酸抑制水的电离,溶液中由水电离出的c(H+)=![]() mol·L-1=3×10-13mol/L;由图中曲线Ⅱ可知,浓度0.1mol·L-1的HB酸溶液的pH=3,Ka(HB)=
mol·L-1=3×10-13mol/L;由图中曲线Ⅱ可知,浓度0.1mol·L-1的HB酸溶液的pH=3,Ka(HB)= 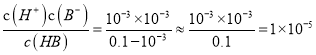 ;(2)曲线I上的c点对应的溶液是HB酸与氢氧化钠完全中和生成的NaB溶液,溶液呈碱性,各离子浓度由大到小的顺序为c(Na+)>c(B-)>c(OH-)>c(H+);b点对应的溶液为以HB和NaB按1:1为溶质的溶液,溶液呈酸性说明HB的电离大于NaB的水解,则c(HB) <c(B-);(3)①若0.1mol·L-1的NaHC溶液的pH=1,则NaHC为强酸的酸式盐,其电离方程式为NAHC=Na++H++C2-;②若在此溶液中能检测到H2C分子,则NAHC是弱酸的酸式盐,溶溶液呈酸性说明HC-电离大于水解,此溶液中c(C2-)>c(H2C);③若H2C的一级电离为H2C=H++HC-,常温下0.1mol·L-1H2C溶液中的c(H+)=0.11mol·L-1,其中一级电离产生的c(H+)=0.1mol·L-1,二级电离不完全电离在第一级电离产生的氢离子抑制下电离的c(H+)=0.01mol·L-1,则0.1mol·L-1NaHC溶液中在没有受抑制情况下电离程度增大,则c(H+)>0.01mol·L-1。
;(2)曲线I上的c点对应的溶液是HB酸与氢氧化钠完全中和生成的NaB溶液,溶液呈碱性,各离子浓度由大到小的顺序为c(Na+)>c(B-)>c(OH-)>c(H+);b点对应的溶液为以HB和NaB按1:1为溶质的溶液,溶液呈酸性说明HB的电离大于NaB的水解,则c(HB) <c(B-);(3)①若0.1mol·L-1的NaHC溶液的pH=1,则NaHC为强酸的酸式盐,其电离方程式为NAHC=Na++H++C2-;②若在此溶液中能检测到H2C分子,则NAHC是弱酸的酸式盐,溶溶液呈酸性说明HC-电离大于水解,此溶液中c(C2-)>c(H2C);③若H2C的一级电离为H2C=H++HC-,常温下0.1mol·L-1H2C溶液中的c(H+)=0.11mol·L-1,其中一级电离产生的c(H+)=0.1mol·L-1,二级电离不完全电离在第一级电离产生的氢离子抑制下电离的c(H+)=0.01mol·L-1,则0.1mol·L-1NaHC溶液中在没有受抑制情况下电离程度增大,则c(H+)>0.01mol·L-1。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案