题目内容
17.3-氯戊烷是一种有机合成中间体,下列有关3-氯戊烷的叙述正确的是( )| A. | 3-氯戊烷的分子式为C5H9Cl3 | B. | 3-氯戊烷属于烷烃 | ||
| C. | 3-氯戊烷能发生取代反应 | D. | 3-氯戊烷的同分异构体共有6种 |
分析 A、3-氯戊烷是在3号碳上含有1个Cl原子的卤代烃;
B、3-氯戊烷含有卤素原子,属于烃的衍生物;
C、3-氯戊烷中含有H原子,能发生取代反应;
D、戊烷有3种同分异构体,其中含有8种H,据此解答即可.
解答 解:A、3-氯戊烷的分子式为:C5H11Cl,故A错误;
B、含有Cl原子、H原子和C原子,属于卤代烃,故B错误;
C、3-氯戊烷能在光照条件下与卤素原子发生取代反应,故C正确;
D、戊烷有3种同分异构体,其中含有8种H,就有8种同分异构体,故D错误,故选C.
点评 本题主要考查的是有机物的命名、分子式书写、卤代烃的性质以及同分异构体判断等,综合性较强,有一定难度.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.在元素周期表中位于金属元素和非金属元素交界处最容易找到的材料是( )
| A. | 制催化剂的材料 | B. | 半导体材料 | ||
| C. | 制农药的材料 | D. | 耐高温、耐腐蚀的合金材料 |
15.反应4A(s)+3B(g)=2C(g)+D(g),经2min后,B的浓度减少了0.6mol/L.下列反应速率的表示正确的是( )
| A. | 用A表示的反应速率是0.4 mol/(L•min) | |
| B. | 用B表示的反应速率是0.3 mol/(L•min) | |
| C. | 2 min末时的反应速率,用B表示是0.3 mol/(L•min) | |
| D. | 用D表示的反应速率为0.1 mol/L |
12.电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.下列说法正确的是( )
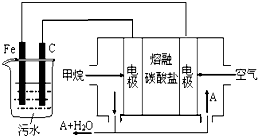

| A. | Fe为阳极,其电极反应为:Fe-3e-+3OH-=Fe(OH)3↓ | |
| B. | 通入甲烷的电极为负极,其电极反应为:CH4-8e-+10OH-=CO32-+7H2O | |
| C. | 为了使该燃料电池长时间稳定运行,电池工作时必须 有部分A物质参加循环.A物质是CO2 | |
| D. | 实验过程中,若在阴极产生了4.48 L气体,则电路中通过的电子个数为0.4NA |
9.下列关于有机物的说法中,错误的是( )
| A. | 乙烯常温下是气体,聚乙烯常温下是固体 | |
| B. | 苯可做有机溶剂 | |
| C. | 乙醇和乙烯都能发生加成反应 | |
| D. | 油脂可用来制造肥皂 |
6.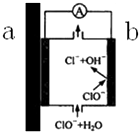 自来水管道经历了从铸铁管→镀锌管→PVC管→PPR热熔管等阶段,铸铁管、镀锌管被弃用的原因之一,可以用原电池原理来解释,示意图如图所示,下列有关说法不正确的是( )
自来水管道经历了从铸铁管→镀锌管→PVC管→PPR热熔管等阶段,铸铁管、镀锌管被弃用的原因之一,可以用原电池原理来解释,示意图如图所示,下列有关说法不正确的是( )
 自来水管道经历了从铸铁管→镀锌管→PVC管→PPR热熔管等阶段,铸铁管、镀锌管被弃用的原因之一,可以用原电池原理来解释,示意图如图所示,下列有关说法不正确的是( )
自来水管道经历了从铸铁管→镀锌管→PVC管→PPR热熔管等阶段,铸铁管、镀锌管被弃用的原因之一,可以用原电池原理来解释,示意图如图所示,下列有关说法不正确的是( )| A. | 如果是镀锌管,则a端为Zn,是负极,产生Zn2+,不但会造成管道锈蚀,Zn2+溶于自来水也对人体有害 | |
| B. | b端发生的电极反应为:ClO-+H2O-2e-═Cl-+2OH- | |
| C. | 由于该原电池原理的存在,一定程度上减弱了自来水中余氯的杀菌消毒功能 | |
| D. | 从自来水厂到用户,经过该类管道的长期接触,自来水的酸碱性发生了变化 |
7.25℃的四种溶液:
①pH=2的CH3COOH溶液②pH=2的HCl溶液③pH=12的氨水④pH=12的NaOH溶液,
有关上述溶液的说法,正确的是( )
①pH=2的CH3COOH溶液②pH=2的HCl溶液③pH=12的氨水④pH=12的NaOH溶液,
有关上述溶液的说法,正确的是( )
| A. | ①、④溶液中水电离的c( H+):①>④ | |
| B. | 将②、③溶液混合后pH=7,则消耗溶液的体积:②<③ | |
| C. | 将①、④溶液混合后pH=8,则c(Na+)-c(CH3COO-)=9.9×10-7mol•L-1 | |
| D. | 分别向等体积的上述溶液中加入100 mL,水,溶液的pH:③>④>①>② |
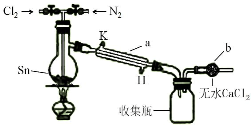 四氯化锡(SnCl4)在电子、化工等领域有重要用途.某兴趣小组拟用Sn和Cl2反应制备SnCl4.
四氯化锡(SnCl4)在电子、化工等领域有重要用途.某兴趣小组拟用Sn和Cl2反应制备SnCl4.