题目内容
总的物质的量为0.50 mol的Fe粉与Al粉混合物分为等质量的两份;在一份中加入足量
的稀盐酸,在标准状况下产生气体a L;在另一份中加入足量的氢氧化钠溶液,在标准状况下产生气体b L。则a+b的数值不可能是
| A.5.6 | B.7.3 | C.8.2 | D.11.2 |
A
解析试题分析:由反应Fe+2HCl→FeCl2+H2↑、2Al+6HCl===2AlCl3+3H2↑
和2Al+2NaOH+2H2O→2NaAlO2+3H2↑。可知:若两等份之一中含有xmolFe、ymolAl。
即x+y=0.25,22.4(x+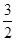 y)=a,22.4×
y)=a,22.4×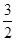 y=b。
y=b。
得出a+b="5.6+44.8y" (0<y<0.25),推出5.6<a+b<16.8
考点:化学计算。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
(14分)
一位同学在复习时遇到这样一道习题:某无色溶液中可能含有“H+、OH-、Na+、NO3-”,加入铝粉后,只产生H2,问该无色溶液中能大量存在哪几种离子。
(1)加入铝粉产生H2,说明铝具有______(填“氧化性”或“还原性”)。
(2)该同学分析:若H+大量存在,则NO3-就不能大量存在。
设计实验证实如下:
| 装 置 | 现 象 |
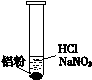 | ⅰ. 实验初始,未见明显现象 ⅱ. 过一会儿,出现气泡,液面上方呈浅棕色 ⅲ. 试管变热,溶液沸腾 |
① 盐酸溶解Al2O3薄膜的离子方程式是______。
② 根据现象ⅱ,推测溶液中产生了NO,为进一步确认,进行如下实验:
| 实 验 | 内 容 | 现 象 |
| 实验1 | 将湿润KI—淀粉试纸置于空气中 | 未变蓝 |
| 实验2 | 用湿润KI—淀粉试纸检验浅棕色气体 | 试纸变蓝 |
b. 实验1的目的是_______。
c. 实验1、2说明反应生成了NO,将生成NO的离子方程式补充完整:
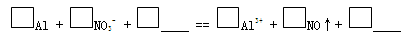
(3)再假设:若OH-大量存在,NO3-也可能不能大量存在。
重新设计实验证实如下:
| 装 置 | 现 象 |
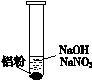 | ⅰ. 实验初始,未见明显现象 ⅱ. 过一会儿,出现气泡,有刺激性气味 |
为确认“刺激性气味”气体,进行如下实验:用湿润KI—淀粉试纸检验,未变蓝;用湿润红色石蕊试纸检验,试纸变蓝。
① 刺激性气味的气体是______。
② 产生该气体的离子方程式是______。
(4)在NaOH溶液中加入铝粉,结果只检验出有H2生成,其化学方程式是______。
(5)实验结果证实:NO3?在酸、碱性环境中都有一定的氧化性,能氧化铝单质,产生含氮化合物。习题中的无色溶液一定能大量存在的是Na+和OH-。
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下: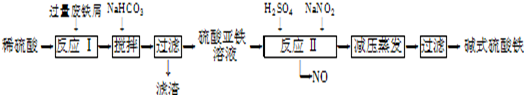
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)加入过量废铁屑的目的是 ;加入少量NaHCO3的目的是调节pH,使溶液中的
(填“Fe3+”“Fe2+”或“Al3+”)沉淀,该工艺中“搅拌”的作用是 。
(2)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作 ,若参与反应的O2有11.2L(标准状况),则相当(3)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成
Fe2(OH)42+聚合离子.该水解反应的离子方程式为 。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-,为检验所得产品中是否含有Fe2+,应使用的试剂为 。(填字母)。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
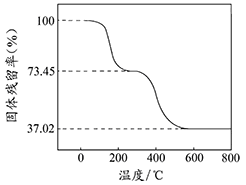
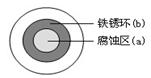
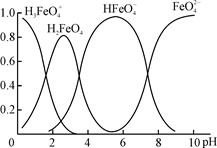


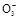
 BaCO3↓+H2O)
BaCO3↓+H2O)