题目内容
7.要证明某溶液中不含 Fe3+而可能含Fe2+,进行如下实验操作时的最佳顺序为( )①加入足量氯水 ②加入足量I2水 ③加入少量KSCN溶液.
| A. | ①③ | B. | ③② | C. | ③① | D. | ①②③ |
分析 亚铁离子遇到硫氰酸钾不变色,可以被氯气氧化为三价铁离子,三价铁离子遇到硫氰酸钾显示红色,据此分析.
解答 解:亚铁离子遇到硫氰酸钾不变色,可以被氯气氧化为三价铁离子,三价铁离子遇到硫氰酸钾显示红色,所以先加入硫氰化钾,不变色,再加氯水,变红色,可以证明亚铁离子的存在,
故选:C.
点评 本题考查了Fe3+和Fe2+的检验,题目难度不大,注意把握Fe3+和Fe2+的检验方法和所用试剂.

练习册系列答案
相关题目
17.分子式为C5H10O2的有机物在酸性条件下可水解为酸和醇,若不考虑立体异构,这些醇和酸重新组合可形成的酯共有( )
| A. | 15种 | B. | 28种 | C. | 32种 | D. | 40种 |
18.下列有关实验操作正确的是( )
| A. | 向酒精灯内添加酒精时,不能多于容积的$\frac{2}{3}$,若不慎洒出的酒精在桌上燃烧,应迅速用水扑灭 | |
| B. | 中和滴定实验中,滴定管、锥形瓶用蒸馏水洗净后须再用待装液润洗后方可使用 | |
| C. | 取少量硫酸亚铁铵晶体放入试管,加入适量NaOH溶液,加热试管,在试管口用湿润的蓝色石蕊试纸检验,则可证明硫酸亚铁铵晶体的成分中含有NH4+ | |
| D. | 探究反应速率影响因素的实验中,以Na2S2O3溶液与稀硫酸反应产生沉淀的快慢为依据来比较不同条件下速率的快慢 |
2.下列关于物质用途的叙述中不正确的是( )
| A. | 单质硅可用于制造光纤和太阳能电池 | |
| B. | 在常温下可用铝制容器贮藏运输浓硫酸 | |
| C. | 食盐是氯碱工业的基础原料 | |
| D. | Na2O2用作呼吸面具的供氧剂 |
12. 向体积为0.5L的AlCl3溶液中逐渐加入某浓度的NaOH溶液,得到的沉淀随NaOH溶液体积的变化如图所示.下列结果不正确的是( )
向体积为0.5L的AlCl3溶液中逐渐加入某浓度的NaOH溶液,得到的沉淀随NaOH溶液体积的变化如图所示.下列结果不正确的是( )
 向体积为0.5L的AlCl3溶液中逐渐加入某浓度的NaOH溶液,得到的沉淀随NaOH溶液体积的变化如图所示.下列结果不正确的是( )
向体积为0.5L的AlCl3溶液中逐渐加入某浓度的NaOH溶液,得到的沉淀随NaOH溶液体积的变化如图所示.下列结果不正确的是( )| A. | 反应过程中,沉淀最多时的质量为78g | |
| B. | 反应过程中,Al3+离子有$\frac{1}{3}$转化为Al(OH)3沉淀,则加入的NaOH溶液的体积可能为3.5L | |
| C. | AlCl3溶液的浓度为2.0 mol/L | |
| D. | 当V(NaOH)=4.0 L时,得到的溶液中Na+、Cl-浓度一定不相等 |
19.下列热化学方程式中,正确的是( )
| A. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 由N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ•mol-1热化学方程式可知,当反应中转移6NA电子时,反应放出的热小于92.4 kJ | |
| C. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| D. | 在101 kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1)△H=-571.6 kJ•mol-1 |
17.核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域.已知只有质子数或中子数为奇数的原子核有NMR现象,试判断下列哪组原子均可产生NMR现象( )
| A. | 18O 31P 119Sn | B. | 27Al 19F 12C | ||
| C. | 14N 17O 1H | D. | 13C ${\;}_{20}^{40}Ca$${\;}_{26}^{56}Fe$ |
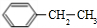 、
、 、
、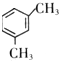 、
、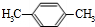 .
.