题目内容
【题目】菠萝酯是一种带有浓郁的菠萝香气和香味的食用香料,其合成路线如下(部分反应条件及产物已略去):
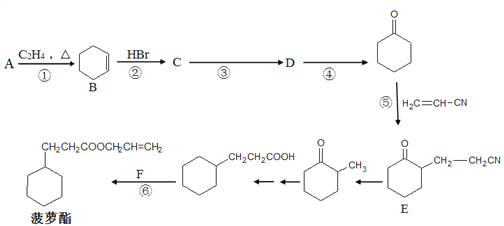
请回答下列问题:
(1) A可用于制备顺丁橡胶(顺式聚1,3-丁二烯),顺丁橡胶的结构简式为_________,若顺丁橡胶的平均相对分子质量为540108,则平均聚合度为__________。
(2) F的结构简式为__________,反应④的条件是________________。
(3) ①一⑥反应中属于取代反应的是__________。
(4) 下列有关B的说法正确的是__________(填字母序号)。
a. 元素分析仪可确定B的实验式为C6H10
b. 质谱仪可检测B的最大质荷比的数值为82
c. 红外光谱仪可测定B中六个碳原子一定在同一平面上
d. 核磁共振仪可测定B有两种类型氢原子吸收峰
(5) 写出反应③的化学方程式_________________。
(6) 同时满足下列条件的E的同分异构体的数目为__________种。
①遇氯化铁溶液显紫色 ②苯环上只有2个取代基且处于对位
(7) 参照上述合成路线,现仅以A为有机原料,无机试剂任选,设计制备![]() 的合成路线。
的合成路线。
已知:①反应物分子的环外双键比环内双键更容易被氧化;
②![]() (R,R’代表烃基或氢)
(R,R’代表烃基或氢)
___________________________________________ 。
【答案】![]() 10002CH2=CH-CH2-OHCu/O2 加热③⑥b
10002CH2=CH-CH2-OHCu/O2 加热③⑥b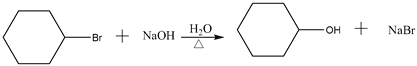 12
12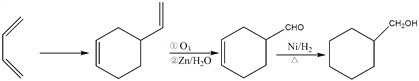
【解析】
试题分析:A可用于制备顺丁橡胶(顺式聚1,3-丁二烯),所以A为1,3-丁二烯,1,3-丁二烯与乙烯发生加成反应生成环己烯,环己烯与HBr发生加成反应生成C为![]() ,C发生水解反应生成D为
,C发生水解反应生成D为![]() ,环己醇发生氧化反应生成
,环己醇发生氧化反应生成![]() ,
,![]() 与CH2=CH-CN发生加成反应生成E,比较菠萝酯和
与CH2=CH-CN发生加成反应生成E,比较菠萝酯和 的结构简式可知,
的结构简式可知, 与F为CH2=CHCH2OH发生酯化反应得到菠萝酯,据此答题。
与F为CH2=CHCH2OH发生酯化反应得到菠萝酯,据此答题。
解析:A可用于制备顺丁橡胶(顺式聚1,3-丁二烯),所以A为1,3-丁二烯,1,3-丁二烯与乙烯发生加成反应生成环己烯,环己烯与HBr发生加成反应生成C为![]() ,C发生水解反应生成D为
,C发生水解反应生成D为![]() ,环己醇发生氧化反应生成
,环己醇发生氧化反应生成![]() ,
,![]() 与CH2=CH-CN发生加成反应生成E,比较菠萝酯和
与CH2=CH-CN发生加成反应生成E,比较菠萝酯和 的结构简式可知,
的结构简式可知, 与F为CH2=CHCH2OH发生酯化反应得到菠萝酯,则
与F为CH2=CHCH2OH发生酯化反应得到菠萝酯,则
(1)顺丁橡胶的链节为![]() ,若顺丁橡胶的平均相对分子质量为540108,则平均聚合度为 540108÷54=10002;
,若顺丁橡胶的平均相对分子质量为540108,则平均聚合度为 540108÷54=10002;
(2)根据上面的分析可知,F的结构简式为 CH2=CH-CH2-OH,反应④为环己醇发生氧化反应,反应的条件是Cu/O2 加热 ;
(3)根据上面的分析可知,①一⑥反应中属于取代反应的是③⑥;
(4)B为![]() ,a.元素分析仪测定元素种类,不能进行定量分析,B的实验式为C3H5,a错误;b.B的相对分子质量为82,故B的最大质荷比的数值为82,b正确;c.红外光谱仪可测定原子团或官能团,不能测定空间构型,c错误;d.分子中含有3种化学环境不同的H原子,核磁共振仪可测定B有3种类型氢原子吸收峰,d错误,答案选b;
,a.元素分析仪测定元素种类,不能进行定量分析,B的实验式为C3H5,a错误;b.B的相对分子质量为82,故B的最大质荷比的数值为82,b正确;c.红外光谱仪可测定原子团或官能团,不能测定空间构型,c错误;d.分子中含有3种化学环境不同的H原子,核磁共振仪可测定B有3种类型氢原子吸收峰,d错误,答案选b;
(5)反应③为![]() 的碱性水解,反应的化学方程式为
的碱性水解,反应的化学方程式为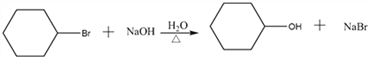 ;
;
(6)根据条件①遇氯化铁溶液显紫色,说明有酚羟基,②苯环上只有2个取代基且处于对位,结合E的结构简式可知,符合条件的结构为苯环上连有-OH、-CH2CH2CH2NH2,或-OH、-CH2CH(NH2)CH3,或-OH、-CH(NH2)CH2CH3,或-OH、-CH(CH3)CH2NH2,或-OH、-CNH2(CH3)2,或-OH、-CH2CH2NHCH3 ,或-OH、-CH2NHCH2CH3 ,或-OH、-NHCH2CH2CH3 ,或-OH、-CH2N(CH3)2,或-OH、-CH(CH3)NHCH3,或-OH、-NHCH(CH3)2,或-OH、-N(CH3)CH2CH3,共12种;
(7)A为1,3-丁二烯,以1,3-丁二烯为有机原料制备![]() ,可以用两分子A发生加成反应生成
,可以用两分子A发生加成反应生成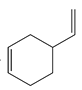 ,
, 发生信息②中反应生成
发生信息②中反应生成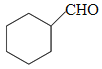 ,
, 与氢气发生全加成反应生成
与氢气发生全加成反应生成![]() ,因此反应的合成路线为
,因此反应的合成路线为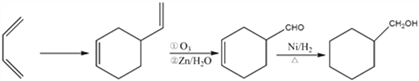 。
。

【题目】下表为元素周期表的一部分请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
⑩ |
(1)⑧、⑩的最高价含氧酸的酸性由强到弱的顺序是__________________。③的最高价氧化物为__________;⑨的最高价含氧酸是__________(均填化学式)
(2)④、⑤、⑥的形成的简单离子半径的大小顺序___________。(用离子符号表示)⑤与水反应的离子方程式___________。
(3)①、④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式:__________。
(4)在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断在相同条件下Se与H2反应的限度_______(选填“更大”“更小”或“相同”)。
【题目】I.AG七种元素中,除F外其他均为短周期主族元素,它们的原子结构或性质如下表所示:
元素 | 原子结构或性质 |
A | 其形成的一种同位素原子在考古中可推测化石的年代 |
B | 与A同周期,其最高价氧化物的水化物无论浓、稀溶液均有强氧化性 |
C | 地壳中含量最多的元素 |
D | D原子的最外层电子数与其电子层数相同,是地壳中含量多的金属元素 |
E | 其单质主要存在于火山口附近 |
F | 生活中常见的金属,它的某种氧化物具有磁性 |
G | G原子与D原子同周期,且原子半径是同周期元素中最大的 |
请回答下列问题:
(1)A在元素周期表中的位置是_______;F的原子结构示意图是_____________。
(2)下列事实能证明C和E的非金属性强弱的是_____。(填序号)
①常温下,C的单质呈气态,E的单质呈固态②C的气态氢化物的温定性强于E的气态氢化物的温定性③C与E形成的化合物中,E呈正价④E的氢化物的沸点高于于C的氢化物的沸点
(3)由A、B、C和氢元素四种元素所形成的阴、阳离子数目之比为1:1的离子化合物是______(填化学式),它与足量NaOH溶液在加热时反应的离子方程式为:_______。
(4)A的氢化物有多种,1 molA的某种氢化物分子中含有14mol电子,请写出该氢化物的电子式:______。己知在25℃、101kPa下,1g该氢化物在足量氧气中完全燃烧生成液态水时放出的热量为40kJ,写出该氢化物燃烧热:_________。
II.甲、乙、丙,丁均为上述元素所形成的物质,甲是单质。它们之间有如下的反应关系:

(1)若乙为淡黄色固体,②③反应均用到同一种液态氢化物,丁物质常用于食品工业。乙所含化学键的类型是________。写出乙→丙的化学方程式:__________。
(2)若丁物成质具有两性,②③反应均要用強碱溶液,④反应是通入过量的—种引起温室效应的主要气体。写出丙→丁的离子方程式:__________。室温下,若由丁物质形成的水溶液中甲离子浓度为1.3×10-6 mol·L-1,则该溶液的pH为______。
(丁的Ksp为1.3×10-33)
