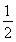题目内容
白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。
(1)已知298 K时白磷、红磷完全燃烧的热化学方程式分别为P4(s,白磷)+5O2(g)=P4O10(s)ΔH1=-2 983.2 kJ·mol-1;P(s,红磷)+ O2(g)=
O2(g)=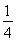 P4O10(s)ΔH2=-738.5 kJ·mol-1,则该温度下白磷转化为红磷的热化学方程式为________________。
P4O10(s)ΔH2=-738.5 kJ·mol-1,则该温度下白磷转化为红磷的热化学方程式为________________。
(2)已知298 K时白磷不完全燃烧的热化学方程式为P4(s,白磷)+3O2(g)=P4O6(s)ΔH=-1 638 kJ·mol-1。在某密闭容器中加入62 g白磷和50.4 L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为________,反应过程中放出的热量为________。
(3)已知白磷和PCl3的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P—P 198,Cl—Cl 243,P—Cl 331。
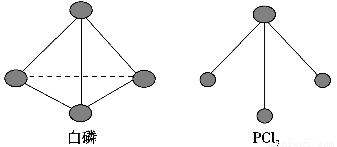
则反应P4(s,白磷)+6Cl2(g)=4PCl3(s)的反应热ΔH=________。
(1)P4(s,白磷)=4P(s,红磷)ΔH=-29.2 kJ·mol-1
(2)3∶1 1 323.45 kJ
(3)-1 326 kJ·mol-1
【解析】(1)根据盖斯定律,由第一个反应-第二个反应×4,可得:P4(s,白磷)=4P(s,红磷) ΔH=-2 983.2 kJ·mol-1-(-738.5 kJ·mol-1)×4=-29.2 kJ·mol-1。(2)n(白磷)=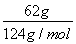 =0.5 mol,n(O2)=
=0.5 mol,n(O2)=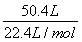 =2.25 mol,设得到的P4O10与P4O6的物质的量分别为x mol、y mol。则x+y=0.5,5x+3y=2.25,解得x=0.375 mol,y=0.125。反应过程中放出的热量为2 983.2 kJ·mol-1×0.375 kJ·mol-1+1 638 kJ·mol-1×0.125 mol=1 323.45 kJ。(3)根据图示,1分子P4、PCl3中分别含有6个P—P键、3个P—Cl键,反应热为断裂6 mol P—P键、6 mol Cl—Cl键吸收的能量和形成12 mol P—Cl键放出的能量之差,即ΔH=(6×198 kJ·mol-1+6×243 kJ·mol-1)-12×331 kJ·mol-1=-1 326 kJ·mol-1。
=2.25 mol,设得到的P4O10与P4O6的物质的量分别为x mol、y mol。则x+y=0.5,5x+3y=2.25,解得x=0.375 mol,y=0.125。反应过程中放出的热量为2 983.2 kJ·mol-1×0.375 kJ·mol-1+1 638 kJ·mol-1×0.125 mol=1 323.45 kJ。(3)根据图示,1分子P4、PCl3中分别含有6个P—P键、3个P—Cl键,反应热为断裂6 mol P—P键、6 mol Cl—Cl键吸收的能量和形成12 mol P—Cl键放出的能量之差,即ΔH=(6×198 kJ·mol-1+6×243 kJ·mol-1)-12×331 kJ·mol-1=-1 326 kJ·mol-1。

 每日10分钟口算心算速算天天练系列答案
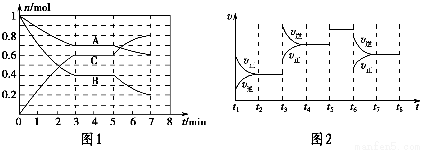
每日10分钟口算心算速算天天练系列答案25 ℃时,在体积为2 L的密闭容器中,气态A、B、C的物质的量n随时间t的变化如图1所示,已知达到平衡后,降低温度,A的转化率将增大。
t2~t3 | t4~t5 | t5~t6 | t7~t8 |
K1 | K2 | K3 | K4 |
(1)根据图1数据,写出该反应的化学方程式:__________________。此反应的平衡常数表达式K=________,从反应开始到第一次平衡时的平均速率v(A)为________。
(2)在5~7 min内,若K值不变,则此处曲线变化的原因是________________。
(3)如图2表示此反应的反应速率v和时间t的关系图,各阶段的平衡常数如表所示。K1、K2、K3、K4之间的关系为________(用“>”、“<”或“=”连接)。A的转化率最大的一段时间是________。