题目内容
【题目】某温度时,在一个容积为2L的密闭容器中,A、B、C三种气态物质的物质的重随时间变化曲线如图所示。请回答以下问题:
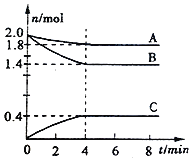
(1)该反应的化学方程式是___________。
(2)反应从开始到平衡时,气体C的平均反应速率是_______ 。
(3)反应达平衡,反应物B的转化率是___;体系的压强是开始时的______倍。
(4)其他条件不变,升高温度,逆反应速率将________(填“加快”、“减慢”或“不变”)。
【答案】 A(g)+3B(g)![]() 2C(g) 0.05mol/(L·min)30%0.9加快
2C(g) 0.05mol/(L·min)30%0.9加快
【解析】
(1)由图可知,A、B为反应物,C为生成物,A、B、C的物质的量的变化量之比为(2-1.8):(2-1.4):(0.4-0)=1:3:2,4min达到平衡,化学计量数之比等于物质的量的变化量之比;(2)结合v=△c/△t计算,(3)根据转化率的公式计算;(4))升高温度,正逆反应速率均增大;
(1)由图可知,A、B为反应物,C为生成物,A、B、C的物质的量的变化量之比为(2-1.8):(2-1.4):(0.4-0)=1:3:2,4min达到平衡,化学计量数之比等于物质的量的变化量之比,则化学反应为A(g)+3B(g)![]() 2C(g);(2)反应从开始到平衡时,气体C的平均反应速率是
2C(g);(2)反应从开始到平衡时,气体C的平均反应速率是
0.4mol/(2L·4min)=0.05mol/(L·min);(3)反应达平衡,反应物B的转化率是(2.0-1.4)mol/2.0mol×100%=30%;体系的压强是开始时的(1.8+0.4+1.4)/(2.0+2.0)=0.9倍。(4)其他条件不变,升高温度,逆反应速率将加快.。

练习册系列答案
相关题目