题目内容
16.下列化学用语书写正确的是( )| A. | 次氯酸的电离方程式:HClO?H++ClO- | |
| B. | 铝溶于烧碱溶液的离子方程式:Al+2OH-═AlO2-+H2↑ | |
| C. | 电解精炼铜的阴极反应式:Cu-2e-═Cu2+ | |
| D. | NaHS水解的离子方程式:HS-+H2O?H3O+S2- |
分析 A.HClO为弱弱电解质,存在电离平衡;
B.漏写氧化剂水;
C.阴极得到电子析出Cu;
D.水解生成氢硫酸、NaOH.
解答 解:A.次氯酸为弱酸,电离方程式为HClO?H++ClO-,故A正确;
B.铝溶于烧碱溶液的离子方程式为2H2O+2Al+2OH-═2AlO2-+3H2↑,故B错误;
C.电解精炼铜的阴极反应式为Cu2++2e-═Cu,故C错误;
D.NaHS水解的离子方程式为HS-+H2O?H2S+OH-,故D错误;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、水解、电离的离子反应考查,综合性较强,题目难度不大.

练习册系列答案
相关题目
4.已知某溶液中存在较多的H+、SO42-、NO3-,则在该溶液中不能大量存在的离子组是( )
①K+、NH4+、F-;②K+、Ba2+、Cl-;③K+、Na+、I-;④K+、Na+、ClO-.
①K+、NH4+、F-;②K+、Ba2+、Cl-;③K+、Na+、I-;④K+、Na+、ClO-.
| A. | ①②③④ | B. | 只有②③④ | C. | 只有①③④ | D. | 只有②③ |
11.称四份0.50g锌,按下列要求分别盛于四支试管里,塞上带导管的塞子,每隔一段时间分别测定生成氢气的体积.
①0.50g锌+5 mL 3 mol/L 硫酸;
②0.50g锌+5 mL 3 mol/L 硫酸+0.1g铜片;
③0.50g锌+5 mL 3 mol/L 硫酸+0.1g铜粉;
④0.50g锌+5 mL 3 mol/L 硫酸+0.39g胆矾(相当于0.1g铜).
下列说法不正确的是( )
①0.50g锌+5 mL 3 mol/L 硫酸;
②0.50g锌+5 mL 3 mol/L 硫酸+0.1g铜片;
③0.50g锌+5 mL 3 mol/L 硫酸+0.1g铜粉;
④0.50g锌+5 mL 3 mol/L 硫酸+0.39g胆矾(相当于0.1g铜).
下列说法不正确的是( )
| A. | 生成氢气的速率从快到慢为④③②① | |
| B. | 四组实验反应完全后生成氢气的总量相等 | |
| C. | 四组实验反应完全后锌均无剩余 | |
| D. | 四组实验反应完全后所得的硫酸锌的物质的量相同 |
1.下列离子方程式正确的是( )
| A. | 向4 mL FeCl2溶液中滴加两滴浓硝酸:Fe2++2H++NO${\;}_{3}^{-}$═Fe3++NO2↑+H2O | |
| B. | 向石灰水中加入过量的NaHCO3溶液:Ca2++2OH-+2HCO${\;}_{3}^{-}$═CaCO3↓+CO${\;}_{3}^{2-}$+2H2O | |
| C. | 铝与稀硫酸反应:Al+2H+═Al3++H2↑ | |
| D. | 向NH4 Al(SO4)2加入少量的NaOH溶液:NH${\;}_{4}^{+}$+OH-═NH3.H2O |
8.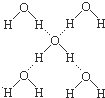 下列有关冰的说法中,正确的组合是( )
下列有关冰的说法中,正确的组合是( )
①水分子间既有氢键又有范德华力;
②每个水分子处在另外四个水分子所围成的四面体中;
③每个O原子处在四个H原子所围成的四面体中;
④冰的结构是由氢键的方向性和饱和性所决定的;
⑤冰中H和O原子之间的作用力不是σ键就是氢键
⑥每个水分子平均拥有四个氢键.
 下列有关冰的说法中,正确的组合是( )
下列有关冰的说法中,正确的组合是( )①水分子间既有氢键又有范德华力;
②每个水分子处在另外四个水分子所围成的四面体中;
③每个O原子处在四个H原子所围成的四面体中;
④冰的结构是由氢键的方向性和饱和性所决定的;
⑤冰中H和O原子之间的作用力不是σ键就是氢键
⑥每个水分子平均拥有四个氢键.
| A. | 除⑥外 | B. | 除④外 | C. | 除④⑤⑥外 | D. | 全对 |
6.下列有关Na2CO3和NaHCO3性质的比较中,说法正确的是( )
| A. | 热稳定性:Na2CO3<NaHCO3 | |
| B. | 常温时水溶性碱性:Na2CO3>NaHCO3 | |
| C. | 等质量的Na2CO3与NaHCO3与过量稀盐酸反应产生的CO2:Na2CO3>NaHCO3 | |
| D. | Na2CO3溶液能与Ca(OH)2溶液反应,而NaHCO3溶液不能与Ca(OH)2溶液反应 |
 如图是三种类别的烃CnH m分子中碳原子数n(C原子)与含碳量C%的关系.
如图是三种类别的烃CnH m分子中碳原子数n(C原子)与含碳量C%的关系.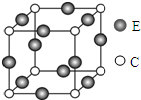 已知A、B、C、D、E五种元素均位于周期表的前四周期,且原子序数依次增大.元素A是周期表中原子半径最小的元素;B的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;D位于第2周期,其原子核外成对电子数是未成对电子数的3倍;E位于ds区,且原子的最外层电子数与A的相同.
已知A、B、C、D、E五种元素均位于周期表的前四周期,且原子序数依次增大.元素A是周期表中原子半径最小的元素;B的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;D位于第2周期,其原子核外成对电子数是未成对电子数的3倍;E位于ds区,且原子的最外层电子数与A的相同.