题目内容
将质量为11.5 g钠和一定量的铝混合放入水中,充分反应共收集到12.32 L气体(标准状况),若反应后溶液的体积为1000 mL,则溶液中所有溶质的物质的量浓度为多少?(写出计算过程)
NaOH:0.3mol/L NaAlO2:0.2 mol/L
试题分析:12.32 L气体(标准状况)的物质的量=
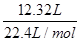 =0.55mol
=0.55mol11.5g钠的物质的量=
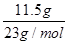 =0.5mol
=0.5mol根据反应的方程式可知
2Na+2H2O=H2↑+2NaOH
2 1 2
0.5mol 0.25mol 0.5mol
这说明铝与氢氧化钠反应生成的氢气物质的量=0.55mol-0.25mol=0.3mol
则根据方程式可知
2Al +2OH-+2H2O=2AlO2-+3H2↑
2 2 2 3
0.2mol 0.2mol 0.2mol 0.3mol
所以反应后氢氧化钠过量,溶液中剩余氢氧化钠的物质的量=0.5mol-0.2mol=0.3mol
NaAlO2的物质的量=0.2 mol/L

练习册系列答案
相关题目