题目内容
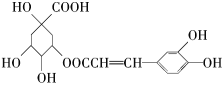
【题目】苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸. 反应原理: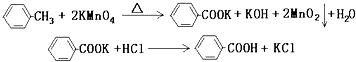
实验方法:一定量的甲苯和KMnO4溶液在 100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.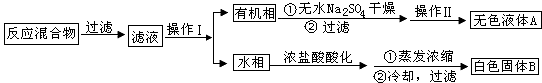
已知:苯甲酸分子量122,熔点 122.4℃,在 25℃和 95℃时溶解度分别为0.3g和6.9g;纯净固体有机物一般都有固定熔点.
(1)操作Ⅰ为 , 操作Ⅱ为 .
(2)无色液体A是
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔. 该同学推测白色固体B是苯甲酸与少量KCl的混合物.
①欲从混合物中提纯苯甲酸,应进行的操作是 , 具体过程包括:加入适量蒸馏水→→→过滤、洗涤、干燥.
②在①提纯过程中,应用对晶体进行洗涤,洗涤的目的是 , 如何检验洗涤已经完全: .
③欲检验经过①提纯后的固体是否纯净,可以采用的实验方法是 , 如果固体纯净,对应的现象是
(4)将提纯后的苯甲酸进行核磁共振氢谱分析,可以得到种峰,峰面积之比为 .
【答案】
(1)分液;蒸馏
(2)甲苯
(3)重结晶;加热溶解;冷却结晶;冷水;除去晶体表面附着的KCl(杂质),提高晶体纯度;取最后一次洗涤液,加入硝酸酸化的AgNO3溶液,没有白色沉淀生成,说明洗涤完全;测定固体熔点;白色晶体在122.4℃左右完全熔化
(4)4;2:2:1:1
【解析】解:一定量的甲苯和适量的KMnO4溶液在100℃反应一段时间后停止反应,按如图流程分离出苯甲酸和回收未反应的甲苯,苯甲酸能溶于水,甲苯不溶于水,互不相溶的液体采用分液方法分离,根据实验目的知,从而得到有机相和水相,有机相中含有甲苯、水相中含有苯甲酸,有机相中的甲苯采用蒸馏方法得到无色液体A,A是甲苯,将水相盐酸酸化再蒸发浓缩,根据苯甲酸的溶解度知,得到的固体B是苯甲酸.(1)分离互不相溶的液体采用分液方法,根据流程图中,水相和有机相不互溶,可以采用分液方法分离,即操作I为分液,有机相中物质互溶且沸点不同,所以可以采用蒸馏方法分离,即操作II为蒸馏,所以答案是:分液;蒸馏;(2)通过以上分析知,A是甲苯,所以答案是:甲苯;(3)通过测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,推测白色固体B是苯甲酸与KCl的混合物,氯化钾可以用硝酸酸化的硝酸银溶液检验氯离子的存在;利用苯甲酸的溶解度特征在25℃和95℃时溶解度分别为0.3g和6.9g;利用不同温度下的溶解度,分离混合物,得到晶体后通过测定熔点判断是否为苯甲酸;①欲从混合物中提纯苯甲酸,应进行的操作是将白色固体B加入水中加热,溶解,冷却、过滤,重结晶,具体过程包括:加入适量蒸馏水→加热溶解→冷却结晶→过滤、洗涤、干燥,所以答案是:重结晶;加热溶解;冷却结晶;②在①提纯过程中,应用冷水对晶体进行洗涤,洗涤的目的是 除去晶体表面附着的KCl(杂质),提高晶体纯度,检验洗涤已经完全:取最后一次洗涤液,加入硝酸酸化的AgNO3溶液,没有白色沉淀生成,说明洗涤完全,
所以答案是:冷水; 除去晶体表面附着的KCl(杂质),提高晶体纯度;取最后一次洗涤液,加入硝酸酸化的AgNO3溶液,没有白色沉淀生成,说明洗涤完全;③欲检验经过①提纯后的固体是否纯净,可以采用的实验方法是干燥白色晶体,加热使其融化,测其熔点,如果固体纯净,对应的现象是 白色晶体在122.4℃左右完全熔化,
所以答案是:测定固体熔点;白色晶体在122.4℃左右完全熔化;(4)苯甲酸分子中羧基中含有一个氢原子,苯环上含有邻间对三种氢原子,邻位2个,间位2个,对位1个,将提纯后的苯甲酸进行核磁共振氢谱分析可以得到4种峰,个数之比等于峰面积之比=2:2:1:1
所以答案是:4;2:2:1:1.

 走进文言文系列答案
走进文言文系列答案【题目】根据题意解答
(1)Fe3+具有氧化性,实验室测定含碘废液中I﹣的含量的过程如下:量取25.00mL废液于250mL锥形瓶中,分别加入5mL 2molL﹣1 H2SO4和10mL 20% Fe2(SO4)3溶液,摇匀.小火加热蒸发至碘完全升华,取下锥形瓶冷却后,加入几滴二苯胺磺酸钠(用作指示剂),用0.02500molL﹣1标准K2Cr2O7溶液进行滴定到终点.重复3次,数据记录如表:
次数 | 1 | 2 | 3 |
滴定体积/mL | 19.98 | 20.02 | 19.00 |
(i)在盛有废液的锥形瓶中先加入5mL 2molL﹣1 H2SO4的目的是 . (用离子方程式和语言叙述解释)
(ii)上述过程中涉及的反应:①2Fe3++2I﹣═2Fe2++I2② .
(iii)根据滴定有关数据,该废液中I﹣含量是gL﹣1 .
(iv)在滴定过程中,下列操作(其他操作正确)会造成测定结果偏低的是 .
A.终点读数时俯视读数,滴定前平视读数
B.锥形瓶水洗衣后未干燥
C.滴定管未用标准K2Cr2O7溶液润洗
D.盛标准K2Cr2O7溶液的滴定管,滴定前有气泡,滴定后无气泡.
(2)Fe3+和Ag+的氧化性相对强弱一直是实验探究的热点.某学习小组同学设计如下实验:
实验编号 | 实验操作 | 现象 |
1 | 向10mL 3mol/L KNO3酸性溶液(pH=1)中插入一根洁净的Ag丝,并滴加NaCl溶液 | 无白色沉淀生成 |
2 | 向10mL 1mol/L AgNO3溶液中滴加2mL 0.1mol/L FeSO4溶液,振荡,再滴加酸性KMnO4溶液 | 紫红色不褪去 |
3 | 向10mL 1mol/L Fe(NO3)3酸性溶液(pH=1)中插入一根洁净的Ag丝,并滴加NaCl溶液 | 有白色沉淀生成 |
请回答:
(i)设计实验①的目的是 .
(ii)实验③可得出结论是 .
(iii)写出实验②中反应的离子方程式
(iv)根据以上实验,Fe3+和Ag+的氧化性相对强弱与离子有关.
【题目】除去下列物质中的少量杂质(括号内),选用的试剂和分离方法不能达到实验目的是( )
混合物 | 试剂 | 分离方法 | |
A | 粗苯甲酸(泥沙等) | 水 | 重结晶 |
B | 甲烷(乙烯) | 高锰酸钾酸性溶液 | 洗气 |
C | 乙炔(硫化氢) | 硫酸铜溶液 | 洗气 |
D | 溴苯(溴) | 稀氢氧化钠溶液 | 分液 |
A.A
B.B
C.C
D.D