题目内容
【题目】羰基法提纯粗镍涉及的两步反应依次为:
(1)Ni(s)+4CO(g)![]() Ni(CO)4(g) ΔH < 0 (2)Ni(CO)4(g)
Ni(CO)4(g) ΔH < 0 (2)Ni(CO)4(g) ![]() Ni(s)+4CO(g),下列说法正确的是
Ni(s)+4CO(g),下列说法正确的是
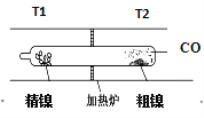
A. T1<T2
B. 可通过高压的方式提高反应(1)中Ni(CO4)的产率
C. 反应(2)平衡后,降低温度,CO浓度减小
D. 升温,反应(1)的气体平均相对分子质量增大
【答案】BC
【解析】
反应(1)Ni(s)+4CO(g)![]() Ni(CO)4(g) ΔH < 0,是放热反应,反应前后气体体积减小;反应(2)Ni(CO)4(g)
Ni(CO)4(g) ΔH < 0,是放热反应,反应前后气体体积减小;反应(2)Ni(CO)4(g) ![]() Ni(s)+4CO(g),是吸热反应,反应前后气体体积增大;利用信息可知,可采取在低温(50℃)时让粗镍和CO作用,使生成的Ni(CO)4在230℃时分解即可得到纯镍,以此分析解答。
Ni(s)+4CO(g),是吸热反应,反应前后气体体积增大;利用信息可知,可采取在低温(50℃)时让粗镍和CO作用,使生成的Ni(CO)4在230℃时分解即可得到纯镍,以此分析解答。
A.由图结合实验原理可知,T2=50℃,T1=230℃,即 T1>T2,故A错误;
B. 反应(1)Ni(s)+4CO(g)![]() Ni(CO)4(g) 中反应前后气体体积减小,根据平衡移动原理,增大压强平衡向正反应方向移动,Ni(CO4)的产率增大,故B正确;
Ni(CO)4(g) 中反应前后气体体积减小,根据平衡移动原理,增大压强平衡向正反应方向移动,Ni(CO4)的产率增大,故B正确;
C. 反应(2)是反应(1)的逆过程,正反应为吸热反应,平衡后,降低温度,平衡向逆向移动,CO浓度减小,故C正确;
D. 反应(1)是放热反应,升温,平衡向逆向移动,气体的物质的量增大,气体总质量减小,根据M=![]() ,气体平均相对分子质量减小,故D错误。
,气体平均相对分子质量减小,故D错误。
答案选BC。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案【题目】资源的高效利用对保护环境、促进经济持续健康发展具有重要作用。某工厂以酸性工业废水(含H+、Al3+、Mg2+、Cr2O72—、SO42—)以及硫酸厂废气(SO2)为原料提取铬的工艺流程如下:
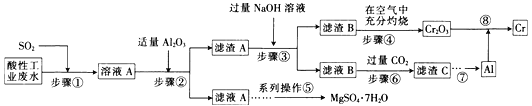
有关数据如下表所示。
化合物 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
完全沉淀的pH | 10.5 | 4.3 | 5.3 |
开始溶解的pH | — | 7.8 | 9.2 |
Ksp近似值 | 5.6×10-12 | 1.3×10-33 | 6.3×10-31 |
请回答下列问题:
(1)步骤①中发生主要反应的离子方程式为__________________________。
(2)步骤②中加入适量Al2O3的目的是__________________________。
(3)为了达到实验目的,步骤③中加入NaOH溶液,应调节溶液的pH范围为_________。
(4)步骤⑥向滤液B中通入过量CO2,反应的离子方程式为__________________________。
(5)工业上也常采用下列装置,利用电解法处理含铬废水。
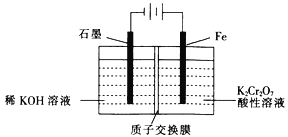
①在电解过程中阳极区pH增大的原因是_______________________。
②理论上每处理含1 mol K2Cr2O7的废水,阴极区得到的气体体积为_________(标准状况)L。