题目内容
(10分)下图中p、q为直流电源两极,A极由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡。试回答:

(1)p为_____极,A极发生了______反应。
(2)C极的电极反应方程式为:______________________;
(3)在电解过程中,测得了C、D两极上产生的气体的实验数据如下:仔细分析以上实验数据,请说出可能的原因是______ 。
(4)电解一段时间后,若将硫酸溶液浓度恢复到电解前,应加入的物质是_____
(5)当电路中通过0.004 mol 电子时,B电极上沉积金属 X的质量为0.128g,则此金属的摩尔质量为_______。
若A电极改用石墨电极电解400mLXSO4溶液,则此时溶液pH为 。

(1)p为_____极,A极发生了______反应。
(2)C极的电极反应方程式为:______________________;
(3)在电解过程中,测得了C、D两极上产生的气体的实验数据如下:仔细分析以上实验数据,请说出可能的原因是______ 。
| 时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 阴极气体体积(cm3) | 6 | 12 | 20 | 29 | 32 | 42 | 52 | 62 | 72 | 82 |
| 阳极气体的体积(cm3) | 2 | 4 | 7 | 11 | 16 | 2l | 26 | 3l | 36 | 41 |
(5)当电路中通过0.004 mol 电子时,B电极上沉积金属 X的质量为0.128g,则此金属的摩尔质量为_______。
若A电极改用石墨电极电解400mLXSO4溶液,则此时溶液pH为 。
(1)正;(1分)氧化
(2)4OH--4e-=O2↑+2H2O
(3)开始反应的1~4min内,由于产生的氧气和氢气在水中的溶解度没有达到饱和,而氧气在水中的溶解度大于氢气,故氢气和氧气的体积比大于2:1,随反应的进行,由于生成的氧气和氢气在水中的溶解均达到饱和故4min后氢气和氧气的体积比等于2:1
(4)水
(5)64g·mol–1,pH = 2
(2)4OH--4e-=O2↑+2H2O
(3)开始反应的1~4min内,由于产生的氧气和氢气在水中的溶解度没有达到饱和,而氧气在水中的溶解度大于氢气,故氢气和氧气的体积比大于2:1,随反应的进行,由于生成的氧气和氢气在水中的溶解均达到饱和故4min后氢气和氧气的体积比等于2:1
(4)水
(5)64g·mol–1,pH = 2
(1)由“接通电源,金属X沉积于B极”说明金属阳离子在B极得电子,即B为阴极(还原反应),A为阳极(氧化反应);q为电源负极,p为电源正极;
(2)C为电解硫酸溶液的阳极:4OH--4e-=O2↑+2H2O
(3)D极为电解硫酸溶液的阴极:2H++2e-=H2↑:开始反应的1~4min内,由于产生的氧气和氢气在水中的溶解度没有达到饱和,而氧气在水中的溶解度大于氢气,故氢气和氧气的体积比大于2:1,随反应的进行,由于生成的氧气和氢气在水中的溶解均达到饱和故4min后氢气和氧气的体积比等于2:1
(4)由电极反应可知,电解硫酸溶液相当于电解水,故若将硫酸溶液浓度恢复到电解前,应加入的物质是水
(5)B电极上的电极反应为:Xn++ne-=X,设X元素的摩尔质量为Mg/mol,则可得到: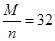 ,当n=2时,M=64g/mol符合实际
,当n=2时,M=64g/mol符合实际
由电极反应:2X2++2H2O=2X+O2↑+4H+(有4个电子转移)可知,当电路中通过0.004 mol 电子时,生成的H+的物质的量为0.004 mol,其浓度为0.01mol/L,pH=2
(2)C为电解硫酸溶液的阳极:4OH--4e-=O2↑+2H2O
(3)D极为电解硫酸溶液的阴极:2H++2e-=H2↑:开始反应的1~4min内,由于产生的氧气和氢气在水中的溶解度没有达到饱和,而氧气在水中的溶解度大于氢气,故氢气和氧气的体积比大于2:1,随反应的进行,由于生成的氧气和氢气在水中的溶解均达到饱和故4min后氢气和氧气的体积比等于2:1
(4)由电极反应可知,电解硫酸溶液相当于电解水,故若将硫酸溶液浓度恢复到电解前,应加入的物质是水
(5)B电极上的电极反应为:Xn++ne-=X,设X元素的摩尔质量为Mg/mol,则可得到:
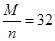 ,当n=2时,M=64g/mol符合实际
,当n=2时,M=64g/mol符合实际由电极反应:2X2++2H2O=2X+O2↑+4H+(有4个电子转移)可知,当电路中通过0.004 mol 电子时,生成的H+的物质的量为0.004 mol,其浓度为0.01mol/L,pH=2

练习册系列答案
相关题目
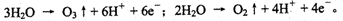
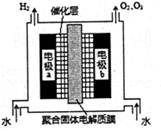
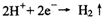
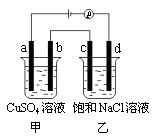
 2NaOH + H2↑+ Cl2
2NaOH + H2↑+ Cl2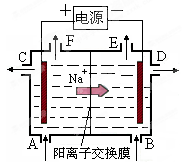
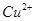 和
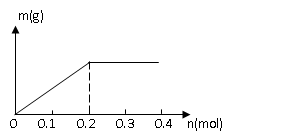
和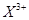 均为0.1mol的溶液,阴极析出金属的质量m(g)与电路中通过电子的物质的量
均为0.1mol的溶液,阴极析出金属的质量m(g)与电路中通过电子的物质的量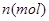 关系如图,则离子的氧化能力由大到小排列正确的是( )
关系如图,则离子的氧化能力由大到小排列正确的是( )