题目内容
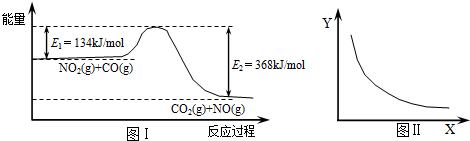
图Ⅰ是NO2(g)+CO(g)?CO2(g)+NO(g)反应过程中能量变化示意图.一定条件下,在固定容积的密闭容器中该反应达到平衡状态.当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ.下列有关说法正确的是( )


分析:A、反应的焓变=拆化学键吸收能量-形成化学键放出能量;
B、增大压强平衡不移动,二氧化氮的转化率不变;
C、反应是放热反应,温度升高反应逆向进行;
D、热化学方程式中反应热数值与化学计量数有关,与参加反应的反应物的物质的量无关;
B、增大压强平衡不移动,二氧化氮的转化率不变;
C、反应是放热反应,温度升高反应逆向进行;
D、热化学方程式中反应热数值与化学计量数有关,与参加反应的反应物的物质的量无关;
解答:解:A、反应的焓变△H=E1-E2=134KJ/mol-368KJ/mol=-234kJ/mol,故A正确;
B、因反应前后气体的体积不变,增大压强平衡不移动,二氧化氮的转化率不变,图象与实际不相符,故B错误;
C、升高温度平衡向吸热方向移动,即向逆反应方向移动,所以CO2的物质的量浓度降低,故C正确;
D、反应放出的热量与参加反应的反应物的物质的量有关,但热化学方程式中反应热数值与化学计量数有关,与参加反应的反应物的物质的量无关,故反应热△H不变,故D错误.
故选AC.
B、因反应前后气体的体积不变,增大压强平衡不移动,二氧化氮的转化率不变,图象与实际不相符,故B错误;
C、升高温度平衡向吸热方向移动,即向逆反应方向移动,所以CO2的物质的量浓度降低,故C正确;
D、反应放出的热量与参加反应的反应物的物质的量有关,但热化学方程式中反应热数值与化学计量数有关,与参加反应的反应物的物质的量无关,故反应热△H不变,故D错误.
故选AC.
点评:本题考查了反应热、化学平衡的影响因素等,难度中等,注意理解平衡移动原理.

练习册系列答案
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
图I是NO2(g)+CO(g) CO2(g)十NO(g)反应过程中能量示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ。
CO2(g)十NO(g)反应过程中能量示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ。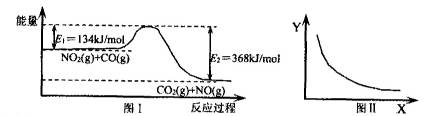
下列有关说法正确的是
| A.该反应的焓变△H=234kJ/mol |
| B.若X表示CO的起始浓度,则Y表示的可能是NO2的转化率 |
| C.若X表示温度,则Y表示的可能是CO2的物质的量浓度 |
| D.若X表示反应时间,则Y表示的可能是混合气体的密度 |