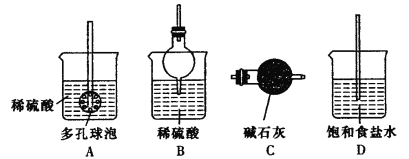
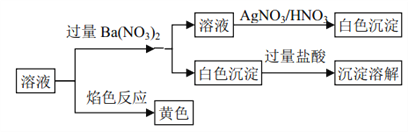
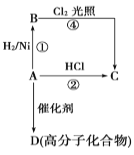
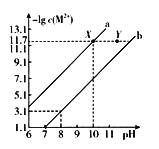
题目内容
【题目】无色透明的锆石(主要成分为ZrSiO4)酷似钻石,是很好的钻石代用品。锆石又称锆英石,常含有铁、铝、铜的氧化物杂质。工业上一种以锆英石为原料制备ZrO2的工艺流程如图所示:

己知:i.Zr在化合物中通常显+4价,“氯化”过程中除C、O元素外,其他元素均转化为高价氯化物;
ii.SiC14极易水解生成硅酸;ZrC14易溶于水,390℃升华;
iii.Fe(SCN)3难溶于有机溶剂MIBK,Zr(SCN)4在水中的溶解度小于在有机溶剂MIBK中的溶解度。
请回答下列问题:
(1)“粉碎”锆英石的目的为 ___。
(2)①“氯化”过程中,锆英石发生的主要反应的化学方程式为 ___。
②“氯化”过程中ZrC14的产率与温度、压强的关系如图所示:
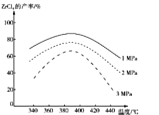
由图可知,“氯化”过程选择的最佳条件为____,“氯化”温度超过390℃时,ZrC14产率降低的原因为 ___。
(3)“滤液1”中含有的阴离子除OH-、Cl-外,还有 _______。
(4)①常用的铜抑制剂有NaCN(氰化钠),NaCN可与铜离子反应生成Cu(CN)2{Ksp[Cu(CN)2]=4×10-10}沉淀。己知盐酸溶解后的溶液中Cu2+的浓度为1 molL-1,当溶液中Cu2+浓度不大于1×10-6 molL-1时即达到后续生产的要求,则欲处理1L该溶液至少需要2molL-1的NaCN溶液的体积为____L(溶液混合时的体积变化忽略不计,计算结果保留两位小数)。
②由于氰化钠有剧毒,所以需要对“废液”中的氰化钠进行处理,通常选用漂白粉或漂白液在碱性条件下将氰化钠氧化,其中一种产物为空气的主要成分。请写出在碱性条件下漂白液与氰化钠反应的离子方程式____。
(5)通过“萃取”“反萃取”可以分离铁,富集锆,原理为____。
【答案】增大反应物接触面积,缩短“氯化”时间,提高锆英石的转化率 ZrSiO4+4Cl2+4CO===ZrCl4+SiCl4+4CO2 1 MPa、390℃ 温度高于390℃,ZrCl4因升华而逸出 AlO2-、SiO32- 1.02 2CN-+5ClO-+2OH-===2CO32-+5Cl-+N2↑+H2O “络合”后Fe3+和Zr4+分别与NH4SCN反应生成Fe(SCN)3和Zr(SCN)4,Fe(SCN)3难溶于MIBK,Zr(SCN)4则被MIBK萃取,进入有机层,再利用H2SO4反萃取Zr(SCN)4,从而达到分离铁,富集锆的目的
【解析】
由题干可知,天然锆英石的主要成分是ZrSiO4,常含有Fe、Al、Cu等金属的氧化物杂质。根据反应流程,将粉碎后的天然锆英石用CO和Cl2氯化,得到ZrCl4、SiCl4、AlCl3、FeCl3、CuCl2,之后用NaOH溶液碱浸,SiCl4、AlCl3被溶解为硅酸钠、偏铝酸钠,过滤后得到滤液1,ZrCl4、FeCl3、CuCl2与NaOH反应生成Zr(OH)4、Fe(OH)3、Cu(OH))2沉淀,过滤后得到滤渣1。滤渣1用盐酸溶解得到ZrCl4、FeCl3、CuCl2的混合溶液,向其中加入铜抑制剂(可以是NaCN,生成沉淀为Cu(CN)2)除去铜,滤渣2即为Cu(CN)2。向滤液2加入NH4SCN,NH4SCN与ZrCl4、FeCl3发生络合反应得到Fe(SCN)3和Zr(SCN)4,加入有机溶剂MIBK萃取,已知Fe(SCN)3难溶于MIBK,Zr(SCN)4易溶于MIBK,所以分液后,Zr(SCN)4在有机层MIBK中。用硫酸将含有Zr(SCN)4的有机层反萃取,使Zr(SCN)4分离出MIBK,通入氨气实现沉锆,最后沉淀经过煅烧得到ZrO2。
结合上述
(1)锆英石“粉碎”后表面积增大,反应速率加快,“氯化”时间缩短,锆英石的转化率提高。故答案为:增大反应物接触面积,缩短“氯化”时间,提高锆英石的转化率;
(2)①根据已知条件i可知,“氯化”过程中除C、O元素外,其他元素均转化为高价氯化物,Zr在化合物中通常显+4价,因此“氯化”过程中,锆英石发生的主要化学反应为ZrSiO4+4Cl2+4CO===ZrCl4+SiCl4+4CO2,此反应体系为无水体系,SiCl4不水解,故答案为:ZrSiO4+4Cl2+4CO===ZrCl4+SiCl4+4CO2;
②由图可知,压强和温度都会影响ZrCl4的产率,图中“氯化”过程中ZrCl4的产率最高时的条件为1 MPa、390℃。由已知条件ii可知ZrCl4易溶于水,390℃升华,因此若“氯化”温度超过390℃,ZrCl4因升华而逸出,导致其产率降低,故答案为:1 MPa、390℃;温度高于390℃,ZrCl4因升华而逸出;
(3)“氯化”后“碱浸”,“氯化”产物ZrCl4与NaOH反应生成难溶于水的Zr(OH)4,SiCl4水解生成的H2SiO3与NaOH反应生成Na2SiO3,Fe3+、Cu2+转化为沉淀,Al3+与过量NaOH溶液反应生成AlO2-,因此,“滤液1”中含有的阴离子除0H、CI外,还有AlO2-、SiO32-,故答案为:AlO2-、SiO32-;
(4)①1 L Cu2+浓度为1 mol/L的溶液中n(Cu2+)=1 mol,消耗2 mol NaCN。c(Cu2+) =1×10-6 mol/L时,![]() ,设至少需要NaCN溶液的体积为V L,则2V-2 =2×10-2×(V+1),解得V≈1.02,故答案为:1.02;
,设至少需要NaCN溶液的体积为V L,则2V-2 =2×10-2×(V+1),解得V≈1.02,故答案为:1.02;
②选用漂白粉或漂白液在碱性条件下将氰化钠氧化,其中一种产物为空气的主要成分,即为N2,因此漂白液与氰化钠反应的离子方程式为:2CN-+5ClO-+2OH-===2CO32-+5Cl-+N2↑+H2O,故答案为:2CN-+5ClO-+2OH-===2CO32-
(5)“滤液2”中含有Fe3+和Zr4+,“络合”后形成Fe(SCN)3和Zr(SCN)4,由已知条件iii可知Fe(SCN)3难溶于MIBK,Zr(SCN)4在水中的溶解度小于在有机溶剂MIBK中的溶解度,通过萃取Zr(SCN)4进入有机层,Fe(SCN)3留在水层,再利用用硫酸将含有Zr(SCN)4的有机层反萃取,从而达到分离铁而富集锆的目的,故答案为:“络合”后Fe3+和Zr4+分别与NH4SCN反应生成Fe(SCN)3和Zr(SCN)4,Fe(SCN)3难溶于MIBK,Zr(SCN)4则被MIBK萃取,进入有机层,再利用H2SO4反萃取Zr(SCN)4,从而达到分离铁,富集锆的目的。

 心算口算巧算一课一练系列答案
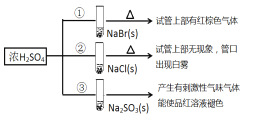
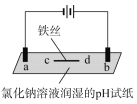
心算口算巧算一课一练系列答案【题目】用石墨电极完成下列电解实验
实验一 | 实验二 | |
装置 |
|
|
现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生…… |
下列对实验现象的解释或推测不合理的是( )
A. a、d处:2H2O+2e-=H2↑+2OH- B. b处:2Cl--2e-=Cl2↑
C. c处发生了反应:Fe-2e-=Fe2+ D. 根据实验一的原理,实验二中m处能析出铜
【题目】CO2的回收与利用是科学家研究的热点课题。可利用CH4与CO2制备合成气(CO、H2),还可制备甲醇、二甲醚、低碳烯经等燃料产品。
I.科学家提出制备“合成气”反应历程分两步:
反应①:CH4(g)C(ads) +2H2(g) (慢反应)
反应②:C(ads) + CO2(g)2CO(g) (快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:
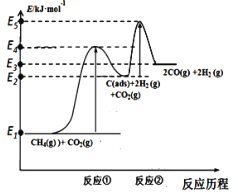
(1)CH4与CO2制备合成气的热化学方程式为____________:该反应在高温下可自发正向进行的原因是_________,能量变化图中:E5+E1___E4+E2(填“>”、“<”或“=”)。
II.利用“合成气”合成申醇后,脱水制得二甲醚。
反应为:2CH3OH(g)CH3OCH3 (g) + H2O(g) △H
经查阅资料,在一定范围内,上述反应化学平衡常数与热力学温度存在如下关系:lnKc=-2.205+![]() 。其速率方程为:v正=k正c2(CH3OH),v逆=k逆c(CH3OCH3)c(H2O),k正、K逆为速率常数,且影响外因只有温度。
。其速率方程为:v正=k正c2(CH3OH),v逆=k逆c(CH3OCH3)c(H2O),k正、K逆为速率常数,且影响外因只有温度。
(2)反应达到平衡后,仅升高温度,k正增大的倍数________ k逆增大的倍数(填“>”、“<”或“= ”)。
(3)某温度下,Kc=200,在密闭容器中加入一定量CH3OH。反应到某时刻测得各组分的物质的量如下:
物质 | CH3OH | CH3OCH3 | H2O |
物质的量/mol | 0.4 | 0.4 | 0.4 |
此时正、逆反应速率的大小:v正 ____v逆(填“>”、“<”或“=”)。
(4)500K下,在密闭容器中加入一定量甲醇CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数为_____(埴标号)
A.![]() B.
B.![]() C.
C.![]() D.无法确定
D.无法确定
Ⅲ.合成低碳烯经
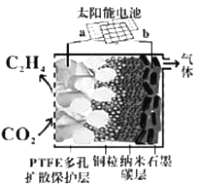
(5)强碱性电催化还原CO2制备乙烯研究取得突破进展,原理如图所示。b极接的是太阳能电池的_______极(已知PTFE浸泡了饱和KCl溶液)。请写出阴极的电极反应式______。