题目内容
【题目】下列实验操作所对应的现象以及结论都正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 用坩埚钳夹住一小块用砂纸打磨过的铝箔,在酒精灯上加热 | 铝箔熔化并滴落 | 金属铝的熔点较低 |
B | 先向某溶液滴加H2O2,然后再滴加几滴KSCN溶液 | 溶液变为红色 | 该溶液中一定含有Fe2+ |
C | 在KI溶液中滴加少量氯水,再加入CCl4,充分振荡 | 液体分层,下层溶液呈紫红色 | 氯的非金属性强于碘 |
D | 向1mL0.1mol/LMgCl2溶液中先滴1~2滴2mol/LNaOH溶液,再滴加2滴0.1mol/L FeCl3溶液,静置 | 先有白色沉淀生成,后白色沉淀变为红褐色 | Ksp[Mg(OH)2]<Ksp[Fe(OH)3] |
A. A B. B C. C D. D
【答案】C
【解析】A项,用坩埚钳夹住一小块用砂纸打磨过的铝箔,在酒精灯上加热,可观察到铝箔熔化但并不滴落,这是因为铝箔表面生成的Al2O3的熔点远高于Al,A项错误;B项,先向某溶液中滴加H2O2,然后再滴加几滴KSCN溶液,溶液变为红色,该溶液中可能含Fe2+或Fe3+或Fe2+和Fe3+,不一定含Fe2+,B项错误;C项,在KI溶液中滴加少量氯水,再加入CCl4,充分振荡,液体分层,下层溶液呈紫红色,说明发生了反应:Cl2+2KI=2KCl+I2,根据同一反应中氧化性:氧化剂![]() 氧化产物得出,氧化性:Cl2
氧化产物得出,氧化性:Cl2![]() I2,说明Cl的非金属性强于I,C项正确;D项,向1mL0.1mol/LMgCl2溶液中滴1~2滴2mol/LNaOH溶液,NaOH完全反应生成白色Mg(OH)2沉淀,再滴加2滴0.1mol/LFeCl3溶液,静置,白色沉淀变为红褐色,说明Mg(OH)2沉淀转化为Fe(OH)3沉淀,根据沉淀转化的一般原则,Ksp[Mg(OH)2]
I2,说明Cl的非金属性强于I,C项正确;D项,向1mL0.1mol/LMgCl2溶液中滴1~2滴2mol/LNaOH溶液,NaOH完全反应生成白色Mg(OH)2沉淀,再滴加2滴0.1mol/LFeCl3溶液,静置,白色沉淀变为红褐色,说明Mg(OH)2沉淀转化为Fe(OH)3沉淀,根据沉淀转化的一般原则,Ksp[Mg(OH)2]![]() Ksp[Fe(OH)3],D项错误;答案选C。
Ksp[Fe(OH)3],D项错误;答案选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
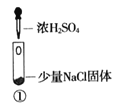
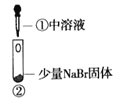
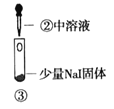
小学生10分钟应用题系列答案【题目】某小组比较Cl-、Br-、I-的还原性,实验如下:
实验1 | 实验2 | 实验3 | |
装置 |
|
|
|
现象 | 试管内颜色无明显变化;用蘸浓氨水的玻璃棒靠近管口,产生白烟 | 溶液变黄;把湿润的KI淀粉试纸靠近试管口,变蓝 | 溶液变深紫色;经检验溶液含单质碘 |
下列对实验的分析不合理的是
A. 实验1中,白烟是NH4Cl
B. 根据实验1和实验2判断还原性:Br->Cl-
C. 根据实验3判断还原性:I->Br-
D. .上述实验利用了浓H2SO4的强氧化性、难挥发性等性质
【题目】2017年12月19日,中国绿色碳汇基金会印发《关于授予江口县“碳汇城市”称号的决定》。我市江口县成为全国第三个、我省首个“碳汇城市”。碳汇,是指通过植树造林、森林管理、植被恢复等措施,利用植物光合作用吸收大气中的二氧化碳6CO2(g) +6H2O(l) === C6H12O6(s)+6O2(g) ,并将其固定在植被和土壤中,从而减少温室气体在大气中浓度的过程、活动或机制。已知每吸收1molCO2需要吸收能量约为470kJ.据此回答下列问题:
(1)碳汇过程中能量的转化形式由__________能转化为___________能;据相关资料表明,每1m3林木,大约能吸收能量为1.88×107kJ,大约可以吸收CO2______吨;葡萄糖燃烧的热化学方程式为:_____________ 。
(2)工业废气中的CO2可用碱液吸收。所发生的反应如下:
CO2(g)+2NaOH(aq)===Na2CO3(aq)+H2O(l) ΔH=-a kJ·mol-1
CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-b kJ·mol-1
则:①反应CO2(g)+H2O(l)+Na2CO3(aq)===2NaHCO3(aq)的ΔH=______ kJ·mol-1(用含a、b的代数式表示)。
(3)生产液晶显示器的过程中使用的化学清洗剂NF3和CO2一样是一种温室气体 ,在大气中的寿命可长达740年之久。以下是几种化学键的键能:
化学键 | N≡N | F—F | N—F |
键能/kJ·mol-1 | 941.7 | 154.8 | 283.0 |
①反应:N2(g)+3F2(g)=2NF3(g)ΔH=_________________
②下列说法中不正确的有_____________
A.过程:N2(g)![]() 2N放出能量
2N放出能量
B.过程:N+3F![]() NF3(g)放出能量
NF3(g)放出能量
C.使用催化剂能减小反应的ΔH