题目内容
【题目】按要求回答下列问题:
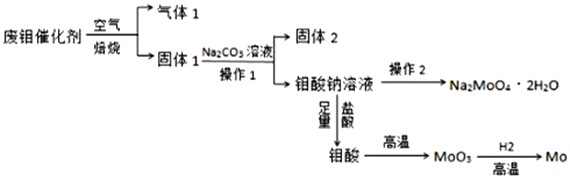
Ⅰ、稀Na2S溶液有一种臭鸡蛋气味,加入AlCl3溶液后,臭鸡蛋气味加剧,用离子方程式表示气味加剧过程所发生的离子反应方程式_________________________________。
Ⅱ、常温下,向20mL 0.2molL﹣1H2A溶液中滴加0.2molL﹣1NaOH溶液.有关微粒的物质的量变化如下图(Ⅰ代表H2A,Ⅱ代表HA﹣,Ⅲ代表A2﹣)

(1)H2A在水中的电离方程式为_________________________。
(2)当V(NaOH)=20 mL时,写出H2A与NaOH反应的离子方程式_________________。此时溶液中所有离子浓度大小关系:__________________。
(3)向NaHA溶液中加水,HA﹣的电离度_________、溶液的pH________。(填增大、减小、不变、无法确定)。
(4)V(NaOH)=30 mL时,溶液中存在如下关系:2c(H+)﹣2c(OH﹣)________2c(A2﹣)﹣3c(H2A)﹣c(HA﹣)(填“<”“>”或“=”)。
(5)某校研究性学习小组开展了题为“H2A是强酸还是弱酸的实验研究”的探究活动。该校研究性学习小组设计了如下方案:你认为下述方案可行的是_______(填编号);
A.测量浓度为0.05 mol/L H2A溶液的pH,若pH大于1,则可证明H2A为弱电解质
B.可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
C.比较中和等体积、等物质的量浓度的硫酸和H2A溶液所需氢氧化钠的量多少,可证明H2A是强酸还是弱酸。
【答案】 2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑ H2A![]() HA﹣+H+,HA﹣
HA﹣+H+,HA﹣![]() A2﹣+H+ OH-+H2A═HA-+H2O c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) 增大 增大 < A
A2﹣+H+ OH-+H2A═HA-+H2O c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) 增大 增大 < A
【解析】Ⅰ、(1)铝离子能与硫离子发生双水解生成氢氧化铝和硫化氢,反应的离子方程式为:2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑,故答案为:2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑;
Ⅱ、(1)根据图像,0.2molL﹣1H2A溶液中存在H2A和HA﹣,以及少量的A2﹣,说明该酸为弱酸,在水中的电离方程式为H2A![]() HA﹣+ H+,HA﹣
HA﹣+ H+,HA﹣![]() A2﹣+ H+,故答案为:H2A
A2﹣+ H+,故答案为:H2A![]() HA﹣+ H+,HA﹣
HA﹣+ H+,HA﹣![]() A2﹣+ H+;
A2﹣+ H+;
(2)当V(NaOH)=20mL时,发生反应为NaOH+H2A═NaHA+H2O,离子方程式为OH-+H2A═HA-+H2O,溶液主要为NaHA,HA-电离大于水解,溶液显酸性,则c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故答案为:OH-+H2A═HA-+H2O;c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-);
(3)根据图像,V(NaOH)=20mL时,为NaHA溶液,溶液中c(A2-)>c(H2A),说明NaHA的电离程度大于水解程度,溶液显酸性,向NaHA溶液中加水,HA﹣的电离度增大,溶液中c(H+)减小,pH增大,故答案为:增大;增大;
(4)当V(NaOH)=30mL时,发生反应为NaOH+H2A=NaHA+H2O,NaHA+NaOH=Na2A+H2O,溶液中含有等物质的量的NaHA,Na2A,根据电荷守恒得:c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-)①,物料守恒可知:3c(HA-)+3c(A2-)+3c(H2A)=2c(Na+)②,①×2+②得:2c(H+)-2c(OH-)=c(A2-)-3c(H2A)-c(HA-)<2c(A2﹣)﹣3c(H2A)﹣c(HA﹣),故答案为:<;
(5)A.测量浓度为0.05 mol/L H2A溶液的pH,若pH大于1,说明H2A未完全电离,则可证明H2A为弱电解质,故A正确;B.可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,可能是NaHA的水解程度小于电离程度,不能证明是强酸,故B错误;C.无论H2A是强酸还是弱酸,中和等体积、等物质的量浓度的硫酸和H2A溶液所需氢氧化钠的量都相同,故C错误;故选A。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】下列实验操作所对应的现象以及结论都正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 用坩埚钳夹住一小块用砂纸打磨过的铝箔,在酒精灯上加热 | 铝箔熔化并滴落 | 金属铝的熔点较低 |
B | 先向某溶液滴加H2O2,然后再滴加几滴KSCN溶液 | 溶液变为红色 | 该溶液中一定含有Fe2+ |
C | 在KI溶液中滴加少量氯水,再加入CCl4,充分振荡 | 液体分层,下层溶液呈紫红色 | 氯的非金属性强于碘 |
D | 向1mL0.1mol/LMgCl2溶液中先滴1~2滴2mol/LNaOH溶液,再滴加2滴0.1mol/L FeCl3溶液,静置 | 先有白色沉淀生成,后白色沉淀变为红褐色 | Ksp[Mg(OH)2]<Ksp[Fe(OH)3] |
A. A B. B C. C D. D