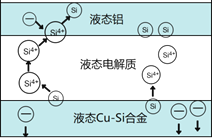
��Ŀ����
����Ŀ��ʵ���ҿ���KMnO4��Ũ���ᷴӦ��ȡ��������仯�ɱ���Ϊ��2KMnO4��16HCl(Ũ) ===2KCl��2MnCl2��5Cl2����8H2O��
��1���뽫������ѧ����ʽ��дΪ���ӷ���ʽ________________��
��2��Ũ�����ڷ�Ӧ����ʾ������������________________(��д���)��
��ֻ�л�ԭ���ڻ�ԭ�Ժ����� ��ֻ���������������Ժ�����
��3���˷�Ӧ������������________���ѧʽ��������0.5 mol Cl2����ת�Ƶĵ��ӵ����ʵ���Ϊ______mol��
��4����˫���ŷ���ʾ�÷�Ӧ�ĵ���ת�Ƶķ������Ŀ_______��
2KMnO4��16HCl(Ũ) ===2KCl��2MnCl2��5Cl2����8H2O
���𰸡�2MnO4����16H����10Cl��===2Mn2+��5Cl2����8H2O �� Cl2 1 
��������
��1�����ݻ�ѧ����ʽ��д��Ӧ�����ӷ���ʽ��
��2�����ݷ�Ӧ����Ԫ�ػ��ϼ������Լ����Ȼ������ɷ���Ũ��������ã�
��3����ԭ����ʧȥ���ӵ�Ԫ���γɵ��������������������Ԫ�صĻ��ϼ۱仯����ת�Ƶ��ӵ����ʵ�����
��4��������Ԫ�غ���Ԫ�صĻ��ϼ۱仯��ϵ��ӵ�ʧ�غ���
��1����Ӧ�е��κ�������ܣ�������ӣ����ʺ�ˮ���ܲ���˷�Ӧ2KMnO4��16HCl(Ũ)��2KCl��2MnCl2��5Cl2����8H2O�����ӷ���ʽΪ2MnO4����16H����10Cl����2Mn2+��5Cl2����8H2O��
��2����Ӧ����Ԫ�ػ��ϼ����ߣ�ʧȥ���ӱ�����������������Ӧ��Ũ�����ڷ�Ӧ����ʾ�����������ǻ�ԭ�ԣ�������Ȼ������ɣ���Ũ���ỹ�������ԣ���ѡ�ڣ�
��3���˷�Ӧ�����ᱻ������������������������Cl2����Ӧ����Ԫ�ػ��ϼ۴�-1�۱�Ϊ0�ۣ�ʧȥ1�����ӣ������0.5 mol Cl2ת�Ƶĵ��ӵ����ʵ���Ϊ0.5mol��2��1mol��
��4����Ӧ��MnԪ�ػ��ϼ۴�+7�۽��͵�+2�۵õ�5�����ӣ���Ԫ�ػ��ϼ۴�-1�۱�Ϊ0�ۣ�ʧȥ1�����ӣ�����˫���ŷ���ʾ�÷�Ӧ�ĵ���ת�Ƶķ������ĿΪ��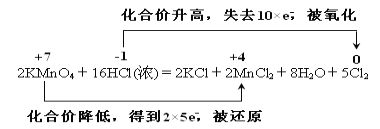 ��
��

 �ǻ�С��ϰϵ�д�
�ǻ�С��ϰϵ�д�