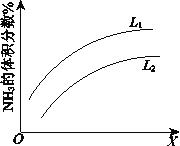
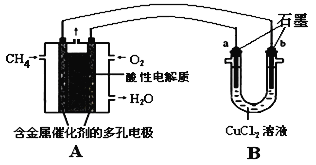
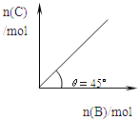��Ŀ����
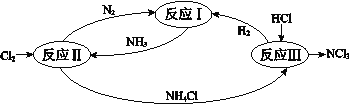
����Ŀ����ͼ��ʾ�ס����ǵ绯ѧʵ��װ�á�

��1�� ���ס������ձ��о�ʢ��NaCl��Һ��
�� ����ʯī���ϵĵ缫��ӦʽΪ______________________________��
�� �����ܷ�Ӧ�����ӷ���ʽΪ________________________________��
�� ��ʪ��ĵ���KI��ֽ�������ձ��Ϸ���������ֽ�ȱ�������ɫ��������Ϊ������Cl2���������ɵ�I2������Ӧ��Cl2��I2�����ʵ���֮��Ϊ5��1�������������ᣬ�÷�Ӧ�Ļ�ѧ����ʽΪ________________________
��2�� ���ס������ձ��о�ʢ��CuSO4��Һ��
�� ���������ϵĵ缫��ӦʽΪ___________________________��
�� �����ʼʱ����ʢ��200 mL pH��5��CuSO4��Һ(25 ��)��һ��ʱ�����Һ��H��Ϊ1����Ҫʹ��Һ�ָ������ǰ��״̬��������Һ�м���__________(��д���ʵĻ�ѧʽ)________g��
���𰸡���1����2H2O+O2+4e-�T4OH-
��2Cl-+2H2O![]() H2��+Cl2��+2OH-
H2��+Cl2��+2OH-
��5Cl2+I2+6H2O�T10HCl+2HIO3
��2����Fe-2e-�TFe2+
��CuO����CuCO3����0.8����1.24��
��������
�����������1�� ���ס������ձ��о�ʢ��NaCl��Һ���� ��Ϊ����������ʴ��ʯī��������ʯī���ϵĵ缫��ӦʽΪ2H2O+O2+4e-�T4OH-���� ���ݵ�������ʯī����������Ϊ�ö��Ե缫����Ȼ�����Һ�������ܷ�Ӧ�����ӷ���ʽΪ2Cl-+2H2O ![]() H2��+Cl2��+2OH-��������Ӧ��Cl2��I2�����ʵ���֮��Ϊ5��1�������������ᣬ���ݵ����غ㣬5mol����ʧ����10mol��2mol I2�õ���10mol����Ļ��ϼ�����Ϊ+5�ۣ��÷�Ӧ�Ļ�ѧ����ʽΪ5Cl2+I2+6H2O�T10HCl+2HIO3����2�� ���ס������ձ��о�ʢ��CuSO4��Һ���� ��Ϊԭ��أ���Ϊ�����������ϵĵ缫��ӦʽΪFe-2e-�TFe2+������2CuSO4+2H2O
H2��+Cl2��+2OH-��������Ӧ��Cl2��I2�����ʵ���֮��Ϊ5��1�������������ᣬ���ݵ����غ㣬5mol����ʧ����10mol��2mol I2�õ���10mol����Ļ��ϼ�����Ϊ+5�ۣ��÷�Ӧ�Ļ�ѧ����ʽΪ5Cl2+I2+6H2O�T10HCl+2HIO3����2�� ���ס������ձ��о�ʢ��CuSO4��Һ���� ��Ϊԭ��أ���Ϊ�����������ϵĵ缫��ӦʽΪFe-2e-�TFe2+������2CuSO4+2H2O![]() 2Cu+O2��+2H2SO4��Ҫʹ��Һ�ָ�ԭ״̬���ɼ���CuO(��CuCO3)��һ��ʱ�����Һ��pH��Ϊ1����c(H+)=0.1mol/L��n(H+)=0.2L��0.1mol/L=0.02mol�����ɵ�ⷴӦ��֪������Cu�����ʵ���Ϊ0.01mol����Cuԭ���غ��֪��m(CuO)=0.01mol��80g/mol=0.8g����m(CuCO3)=0.01mol��124g/mol=1.24g��
2Cu+O2��+2H2SO4��Ҫʹ��Һ�ָ�ԭ״̬���ɼ���CuO(��CuCO3)��һ��ʱ�����Һ��pH��Ϊ1����c(H+)=0.1mol/L��n(H+)=0.2L��0.1mol/L=0.02mol�����ɵ�ⷴӦ��֪������Cu�����ʵ���Ϊ0.01mol����Cuԭ���غ��֪��m(CuO)=0.01mol��80g/mol=0.8g����m(CuCO3)=0.01mol��124g/mol=1.24g��

 ��ɢ˼ά�¿���ϵ�д�
��ɢ˼ά�¿���ϵ�д�