题目内容
【题目】Ⅰ 能源短缺是人类面临的重大问题。甲醇是一种可再生能源.具有广泛的开发和应用前景。因此甲醇被称为21世纪的新型燃料。
(1)已知在常温常压下:
①2CH3OH(l)十3O2(g) 2CO2(g)+4H2O(g) △H=—1275.6 kJ·mol—1
②H2O(l) H2O(g) △H=+44.0 kJ.mol-1
写出表示甲醇燃烧热的热化学方程式 。
(2)某种甲醇—空气燃料电池是采用铂作为电极,稀硫酸作电解质溶液。其工作时负极的电极反应式可表示为 。
Ⅱ 甲烷也是一种清洁燃料,但不完全燃烧时热效率降低并会产生有毒气体造成污染。
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=―890.3kJ/mol
2CO(g)+O2(g)=2CO2(g) ΔH2=―566.0kJ/mol
(3)则甲烷不完全燃烧生成一氧化碳和液态水时的热效率只是完全燃烧时的________倍(计算结果保留1位小数)。
(4)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol/L的氯化铜溶液的装置示意图:
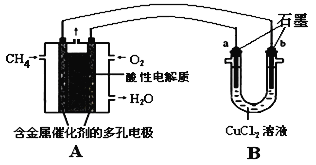
请回答:当线路中有0.1 mol电子通过时,________(填“a”或“b”)极增重________g。
【答案】(1)CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ΔH=-725.76kJ·mol-1
(2)![]()
(3)0.7 (4)b 3.2
【解析】
试题分析:(1)根据盖斯定律,①×![]() -②×2得甲醇燃烧热的热化学方程式CH3OH(l) + 3/2O2(g) = CO2(g) + 2H2O(l) ΔH=-725.76 kJ·mol-1 ;(2)依据甲醇燃烧的反应原理,结合如图所示的原电池装置,负极上失电子发生氧化反应,正极上得到电子发生还原反应;一般燃料在负极上发生反应,氧气再正极发生还原反应,负极的电极反应式可表示为
-②×2得甲醇燃烧热的热化学方程式CH3OH(l) + 3/2O2(g) = CO2(g) + 2H2O(l) ΔH=-725.76 kJ·mol-1 ;(2)依据甲醇燃烧的反应原理,结合如图所示的原电池装置,负极上失电子发生氧化反应,正极上得到电子发生还原反应;一般燃料在负极上发生反应,氧气再正极发生还原反应,负极的电极反应式可表示为![]() ;(3)根据盖斯定律,甲烷不完全燃烧生成一氧化碳和液态水的热方程式为CH4 (g)+3/2O2(g)=CO (g)+2H2O(l) ΔH=-607.3kJ·mol-1,热效率只是完全燃烧时的
;(3)根据盖斯定律,甲烷不完全燃烧生成一氧化碳和液态水的热方程式为CH4 (g)+3/2O2(g)=CO (g)+2H2O(l) ΔH=-607.3kJ·mol-1,热效率只是完全燃烧时的![]() 倍;(4)根据图示,通入甲烷的一极为负极,则电解池a是阴极,a极反应为
倍;(4)根据图示,通入甲烷的一极为负极,则电解池a是阴极,a极反应为![]() ,设生成铜xg;
,设生成铜xg;
![]()
2mol 64g
0.1mol xg
![]() 得
得![]() ,当线路中有0.1 mol电子通过时,a极增重3.2g。
,当线路中有0.1 mol电子通过时,a极增重3.2g。