题目内容
下列溶液中Cl-的物质的量浓度与50mL 1mol/L FeCl3溶液中Cl-物质的量浓度相等是( )
| A、100mL 1mol/L NaCl溶液 |
| B、75mL 1mol/L MgCl2溶液 |
| C、150mL 3mol/L KCl溶液 |
| D、25mL 2mol/L AlCl3溶液 |
考点:物质的量浓度
专题:物质的量浓度和溶解度专题
分析:溶液中氯离子的物质的量浓度=盐的浓度×化学式中氯离子个数,据此分析解答.
解答:
解:50mL 1mol/L FeCl3溶液中Cl-物质的量浓度为3mol/L,
A、100mL 1mol/L NaCl溶液中c(Cl-)=1mol?L-1×1=1mol/L.
B、75mL 1mol/L MgCl2溶液中c(Cl-)=1 mol?L-1×2=2mol/L.
C、150mL 3mol/L KCl溶液中c(Cl-)=3 mol?L-1×1=3mol/L.
D、25mL 2mol/L AlCl3溶液中c(Cl-)=2mol?L-1×3=6mol/L.
故选C.
A、100mL 1mol/L NaCl溶液中c(Cl-)=1mol?L-1×1=1mol/L.
B、75mL 1mol/L MgCl2溶液中c(Cl-)=1 mol?L-1×2=2mol/L.
C、150mL 3mol/L KCl溶液中c(Cl-)=3 mol?L-1×1=3mol/L.
D、25mL 2mol/L AlCl3溶液中c(Cl-)=2mol?L-1×3=6mol/L.
故选C.
点评:本题考查了溶液中氯离子物质的量浓度的计算,难度不大,溶液中氯离子的物质的量浓度为盐的浓度与化学式中离子个数的积.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
2SO2(g)+O2(g)
2SO3(g)是制备硫酸的重要反应之一.下列叙述正确的是( )
| V2O5 |
| △ |
| A、催化剂V2O5,不改变该反应的逆反应速率 | ||
| B、将2mol SO2与2mol O2放人密闭容器中,最终生成2mol SO3 | ||
C、在t1、t2时刻,SO2(g)的浓度分别是C1、C2,则时间间隔t1-t2内,SO2(g)消耗的平均速率为v=
| ||
| D、该反应是放热反应,则SO2的能量一定大于SO3的能量 |
下列关于有机物的命名中不正确的是( )
| A、2-二甲基戊烷 |
| B、2-乙基戊烷 |
| C、2,3-二甲基戊烷 |
| D、3-甲基己烷 |
下列离子方程式的书写正确的是( )
| A、FeBr2溶液中通入过量的Cl2时的离子方程式:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | ||||
| B、玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2Na++2OH-═Na2SiO3↓+H2O | ||||
| C、氯气通入水中:Cl2+H2O═2H++Cl-+ClO- | ||||
D、2Cl-+2H2O
|
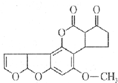 前不久,各大媒体在显著的位置刊登了关于900t致癌大米的报道,主要是变质大米中存在的黄曲霉素使人体中的特殊基因发生突变,有转变成肝癌的可能性.它的结构如图所示,和l mol该化合物起反应的H2或NaOH的最大值分别是( )
前不久,各大媒体在显著的位置刊登了关于900t致癌大米的报道,主要是变质大米中存在的黄曲霉素使人体中的特殊基因发生突变,有转变成肝癌的可能性.它的结构如图所示,和l mol该化合物起反应的H2或NaOH的最大值分别是( )| A、5mol,2mol |
| B、7mol,2mol |
| C、6mol,1mol |
| D、7mol,1mol |
为了提纯下列物质(括号内为杂质),有关除杂试剂和分离方法的选择均正确的是( )
| 编号 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 己烷(己烯) | 溴水 | 分液 |
| B | 淀粉溶液(NaCl) | 水 | 过滤 |
| C | 工业酒精(少量水) | 生石灰 | 蒸馏 |
| D | 甲烷(乙烯) | KMnO4酸性溶液 | 洗气 |
| A、A | B、B | C、C | D、D |
下列关于粒子结构的描述不正确的是( )
| A、NF3和BF3是中心原子杂化类型相同的极性分子 |
| B、CH2Cl2和C2H4是空间构型不同的非极性分子 |
| C、在SiO2晶体中,Si原子与Si-O键数目比为1:2 |
| D、CF4和CO2是含极性键的非极性分子 |
在密闭容器中一定量混合气体发生反应:2A(g)+B(g)?xC(g),达到平衡时测得 A的浓度为 0.5mol/L,在温度不变的条件下,将容器的容积扩大到原来的2倍,再达平衡时测得A的浓度为 0.3mol/L,下列有关判断正确的是( )
| A、x=3 |
| B、平衡向正反应方向移动 |
| C、B的转化率降低 |
| D、C的体积分数增大 |
下列做法中不会对人体造成危害的是( )
| A、每天饮食中搭配一定量的蔬菜、水果,以满足人体对维生素C的需要 |
| B、将含有甲醇(CH3OH)的工业酒精兑制成饮用白酒出售,以提高利润 |
| C、在某些食品中添加苏丹红(色素),使食品的色泽更加诱人 |
| D、用福尔马林(35%-40%甲醛水溶液)浸泡海产品,防腐保鲜 |