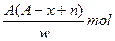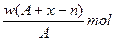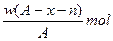题目内容
(12分)X、Y、Z、W、N五种元素中,X原子核外的M层中只有两个成对电子,Y原子的外围电子排布式为nsnnpn+1,Z是地壳内含量(质量分数)最高的元素,W的核电荷数是X与Z的核电荷数之和,N在元素周期表的各元素中电负性最大。
(1)Z元素基态原子的电子排布图为
(2)W的元素符号是 ,在周期表中的位置是 ,其基态原子的电子排布式为 ,在形成化合物时它的最高化合价为
(3)Y的氢化物的VSEPR模型是 ,属于 分子(填极性或非极性),
(4)X的氢化物的沸点 Z的氢化物的沸点(填大于、小于或等于)
原因是
(5)用氢键表示式写出N的氢化物溶液中存在的所有氢键
(1)Z元素基态原子的电子排布图为
(2)W的元素符号是 ,在周期表中的位置是 ,其基态原子的电子排布式为 ,在形成化合物时它的最高化合价为
(3)Y的氢化物的VSEPR模型是 ,属于 分子(填极性或非极性),
(4)X的氢化物的沸点 Z的氢化物的沸点(填大于、小于或等于)
原因是
(5)用氢键表示式写出N的氢化物溶液中存在的所有氢键
(12分)(1)电子排布图:
(2) Cr ,第四周期第VIB族, 1s22s2p63s23p63d54s1 , +6价
(3)VSEPR模型是 四面体形 ,属于 极性 分子
(4)X的氢化物的沸点 小于 Z的氢化物的沸点(填大于、小于或等于)
原因是水分子间能形成氢键使水的沸点大于硫化氢
(5)F—H…F F—H…O O—H…F O—H…O
(2) Cr ,第四周期第VIB族, 1s22s2p63s23p63d54s1 , +6价
(3)VSEPR模型是 四面体形 ,属于 极性 分子
(4)X的氢化物的沸点 小于 Z的氢化物的沸点(填大于、小于或等于)
原因是水分子间能形成氢键使水的沸点大于硫化氢
(5)F—H…F F—H…O O—H…F O—H…O
略

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案
相关题目

 3受热分解生成Li2O和CO2
3受热分解生成Li2O和CO2