题目内容
【题目】锑(Sb)及其化合物的用途广泛。锑与砷同族,以辉锑矿为原料制备金属锑,其中一种工艺流程如图甲所示:
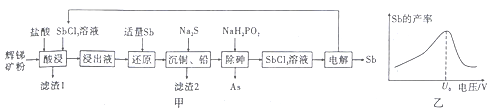
已知部分信息如下:
Ⅰ.辉锑矿(主要成分为Sb2S3,还含有As2S5、PbS、CuO和SiO2等);
Ⅱ.浸出液主要含盐酸和SbCl3,还含SbCl5、CuCl2、AsCl3和PbCl2等杂质;
Ⅲ.常温下,Ksp(CuS)=10×10-36、Ksp(PbS)=9.0×10-29
Ⅳ.H3PO2是一元中强酸。
回答下列问题:
(1)锑在周期表中的位置是___________,NaH2PO2的名称为________________。
(2)“酸浸”过程中SbCl5和Sb2S3反应有S生成,滤渣1的主要成分是__________(填化学式)。
(3)写出“还原”过程中反应的化学方程式:_____________________。
(4)已知浸出液中:c(Cu2+)=0.01mol·L-1、c(Pb2+)=0.10mol·L-1。在沉淀铜、铅过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是________________(填化学式);加入硫化钠的量不宜过多,原因是__________________ 。
(5)在“除砷”过程中,氧化产物为H3PO4。该反应中还原剂、氧化剂的物质的量之比为______。
(6)“电解”中锑的产率与电压大小关系如图乙所示。当电压超过U0V时,锑的产率降低的原因可能是__________________。
【答案】 第五周期第ⅤA族 次磷酸钠 SiO2和S 3SbCl5+2Sb=5SbCl3 CuS 避免锑离子沉淀,使锑的产率降低 3︰4 H+参与了电极反应
【解析】(1)锑与氮、磷同族,在周期表中的位置是第五周期第ⅤA族;根据信息Ⅳ次磷酸H3PO2为一元中强酸,其电离方程式为H3PO2H2PO2-+H+, NaH2PO2为一元强碱和一元中强酸形成的正盐,其名称为次磷酸钠。答案为:第五周期第ⅤA族 ; 次磷酸钠
(2)根据题目信息,辉锑矿的主要成分为Sb2S3,还含有As2S5、PbS、CuO和SiO2等,加入盐酸酸浸后,其中的的SiO2不与盐酸反应,SbCl5和Sb2S3反应有S生成,则滤渣1的主要成分是SiO2和S。答案为:SiO2和S
(3)联系流程最后一步电解SbCl3溶液获取Sb,可知浸出液中加入Sb的目的是将其中的SbCl5还原为SbCl3,则“还原”过程中反应的化学方程式为:3SbCl5+2Sb=5SbCl3。答案为:3SbCl5+2Sb=5SbCl3
(4)根据信息知Ⅲ.常温下,Ksp(Cu)=1.0×10-36、Ksp(PbS)=9.0×10-29,又溶液中 c(Cu2+)=0.01mol·L-1可知CuS从溶液中沉淀出来,需![]() ,同理PbS从溶液中沉淀出来,需
,同理PbS从溶液中沉淀出来,需![]() 9.0×10-28,综上可知CuS先从溶液中沉淀出来;为避免锑离子沉淀,使锑的产率降低,加入硫化钠的量不宜过多。答案为:CuS ; 避免锑离子沉淀,使锑的产率降低
9.0×10-28,综上可知CuS先从溶液中沉淀出来;为避免锑离子沉淀,使锑的产率降低,加入硫化钠的量不宜过多。答案为:CuS ; 避免锑离子沉淀,使锑的产率降低
(5)在“除砷”过程中,NaH2PO2被氧化为为H3PO4,磷元素化合价由+1价升高到+5价,变化4,AsCl3 被NaH2PO2还原为As,砷元素化合价由+3价降低到0价,变化3;根据氧化还原反应前后得失电子数目守恒,可知参加反应的还原剂NaH2PO2与氧化剂AsCl3物质的量之比为3:4。答案为:3:4
(6)电解SbCl3过程中,阳离子Sb3+在阴极得电子产物为Sb,当电压超过U0V时,锑的产率降低的原因可能是溶液中阳离子H+亦在阴极得电子参与了电极反应。答案为:H+参与了电极反应