题目内容
【题目】A、B、C、D四种元素位于短周期内,B、C、D的原子序数依次递增。A原子核内有一个质子,B原子的电子总数与D原子最外层电子数相等,D原子最外层电子数是其电子层数的3倍,由此推断:
(1)A与D组成的化合物中,含有非极性键的分子的电子式________。画出 D2-的结构示意图____________________。
(2)用电子式表示B与D组成的三原子分子的形成过程_________________。
(3)A和C组成的化合物CA3易液化的原因______________。
(4)已知A、B、C、D可组成一种化合物,其原子个数比为8︰1︰2︰3,该化合物的化学式为__________,属__________(离子、共价)化合物。
【答案】 ![]()
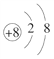
![]() 氢键 (NH4)2CO3 离子
氢键 (NH4)2CO3 离子
【解析】A、B、C、D四种短周期元素,B、C、D的原子序数依次递增。A原子核内仅有1个质子,应为H元素;D原子最外层电子数是其电子层数的3倍,则有两个电子层,最外层电子数为6,则D为O元素;B原子的电子总数与D原子的最外层电子数相等,则B为C元素;C的原子序数介于C、O之间,所以C是N元素;结合元素化合物的性质解答.
(1)A与D组成的化合物中,含有非极性键的分子为H2O2,分子中存在两个氧氢键和一个OO键,双氧水的电子式为:![]() ,D2-为O2-,结构示意图为:
,D2-为O2-,结构示意图为: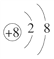 ,答案为:
,答案为:![]() 、
、
(2)B与D组成的三原子分子为CO2,用电子式表示形成过程为:![]() ,答案为:
,答案为:![]()
(3)A和C组成的化合物CA3为NH3, NH3分子间易形成氢键,导致NH3易液化,答案为:氢键
(4)A、B、C、D组成化合物,其原子个数比为8︰1︰2︰3,则该化合物的化学式为(NH4)2CO3,(NH4)2CO3中铵根离子与碳酸根离子之间以离子键结合,所以属于离子化合物,答案为:(NH4)2CO3、离子

 阅读快车系列答案
阅读快车系列答案【题目】如图是立方烷(cunane)的球棍模型,下列有关说法不正确的是( ) 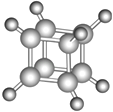
A.其一氯代物只有一种
B.其二氯代物有三种同分异构体
C.常温下为气体
D.它与苯乙烯(C6H5﹣CH═CH2)互为同分异构体
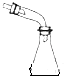
【题目】下列选用的仪器和药品能达到实验目的是( )
A | B | C | D |
|
| 饱和NaHSO3溶液 | |
制乙炔的发生装置 | 蒸馏时的接收装置 | 除去SO2中的少量HCl | 准确量取一定体积K2Cr2O7标准溶液 |
A.A
B.B
C.C
D.D