题目内容
【题目】ClO2气体是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒.
(1)消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,在这个过程中,Fe2+、Mn2+的化合价升高,说明ClO2具有______性.
(2)工业上可以通过下列方法制取ClO2,请完成该化学反应方程式:2KClO3+SO2==2ClO2+_____。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,写出化学方程式:_____________
(4)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8mg/L之间。碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ加入一定量的Na2S2O3溶液。(已知:2S2O32-+I2== S4O62-+2I-)
Ⅲ加硫酸调节水样pH至1~3。
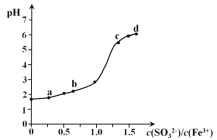
操作时,不同pH环境中粒子种类如图所示:

请回答:
①操作Ⅰ中反应的离子方程式是_____。
②在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是_____。
③若水样的体积为1.0L,在操作Ⅱ时消耗了1.0×10-3mol/L的Na2S2O3溶液10ml,则水样中ClO2的浓度是_____ mg/L。
【答案】氧化性 K2SO4 2Cl2 + 2H2O(g)+ C═4HCl + CO2 2ClO2 + 2I- = 2ClO2- + I2 ClO2- + 4I- + 4H+ = Cl- + 2I2 + 2H2O 0.675
【解析】
(1)在这个过程中,Fe2+、Mn2+的化合价升高,则ClO2的化合价降低,为氧化剂,具有氧化性,故答案为:氧化性;
(2)质量守恒可得:2KClO3+SO2=2ClO2+K2SO4,故答案为:K2SO4;
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2是放热反应,化学方程式为2Cl2 + 2H2O(g)+ C═4HCl + CO2,故答案为:2Cl2 + 2H2O(g)+ C═4HCl + CO2;
(4)①用氢氧化钠溶液调至中性,由图知,此条件下粒子种类为 ClO2,ClO2将加入的碘化钾氧化为I2,自身被还原成ClO2-,离子方程式为:2ClO2 + 2I- = 2ClO2- + I2,故答案为:2ClO2 + 2I- = 2ClO2- + I2;
②由图示表明,pH至1~3时,ClO2-将I-氧化成I2,离子方程式为:ClO2- + 4I- + 4H+ = Cl- + 2I2 + 2H2O;故答案为:ClO2- + 4I- + 4H+ = Cl- + 2I2 + 2H2O;
③S2O32- ~ I- ~ ClO2
1 1 1
1.0×10-3 mol/L×0.01L 1.0×10-5mol
m(ClO2)=n(ClO2)×M(ClO2)=1.0×10-5mol×67.5×103mgmol-1=0.675mg,由于水样为 1L,所以 ClO2 的浓度为![]() =0.675 mgL-1,故答案为:0.675。
=0.675 mgL-1,故答案为:0.675。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案【题目】硫是生物必需的大量营养元素之一,下图是自然界中硫的循环图,请分析此图并回答有关问题。

(1)氮循环和硫循环是自然界中两种重要的元素循环过程,下列关于这两种循环的说法正确的是________。
选项 | 比较 | 氮循环 | 硫循环 |
A | 异 | 氮元素会进入大气 | 硫元素不会进入大气 |
B | 氮循环过程有生物圈参与 | 硫循环过程无生物圈参与 | |
C | 同 | 人类活动对氮循环和硫循环都造成巨大影响 | |
D | 氮循环和硫循环对环境的影响是都能导致温室效应 | ||
(2)分解者可将含硫有机物分解为H2S,硫磺细菌和硫化细菌可将H2S进一步变为硫单质或硫酸盐,下列关于硫化氢说法正确的是_______。
A.H2S分子很稳定,受热难分解
B. H2S分子中所有原子的最外层都达到8电子结构
C.将H2S通入FeSO4溶液,产生沉淀
D.H2S中硫元素为-2价,因此H2S只有还原性,没有氧化性
E.H2S是一种无色臭鸡蛋气味的有毒气体
(3)大气中的SO2经过一系列转化最终生成H2SO4,导致降水具有较强酸性,称为酸雨。检验某次降雨是否为酸雨的方法是_________________,收集某次酸雨样品,发现8小时内,样品pH一直在减小,其原因可能是________________。(用化学方程式表示)
(4)为了防治酸雨,工业上常采用“钙基固硫法”即将生石灰和含硫的煤混合后燃烧,燃烧时硫、氧气和生石灰共同作用,使硫元素转移到炉渣中,大部分硫元素最终转化为固体盐是_______(填化学式)。
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | M层上电子数是K层上电子数的3倍 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
(1)元素X位于元素周期表的第____周期第__族,它的一种核素可测定文物年代,这种核素的符号是____。
(2)元素Y的原子结构示意图为___,与氢元素形成一种离子YH4+,写出某溶液中含有该微粒的检验方法_____。
(3)元素Z与元素T相比,非金属性较强的是___(用元素符号表示),下列表述中能证明这一事实的是___。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种的是____,理由______。