题目内容
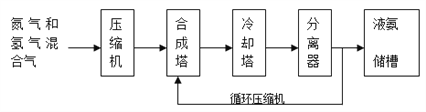
【题目】氨气有广泛用途,工业上利用反应N2(g)+3H2(g) ![]() 2NH3(g) H<0合成氨,其基本合成过程如下:
2NH3(g) H<0合成氨,其基本合成过程如下:
(1)某小组为了探究外界条件对反应的影响,以c0 mol/L H2参加合成氨反应,在a、b两种条件下分别达到平衡,如图A。
①a条件下,0~t0的平均反应速率v(N2)=___________mol·L-1·min-1。
②相对a而言,b可能改变的条件是______________________________。
③在a条件下t1时刻将容器体积压缩至原来的1/2,t2时刻重新建立平衡状态。请在答题卡相应位置画出t1~t2时刻c(H2)的变化曲线________。
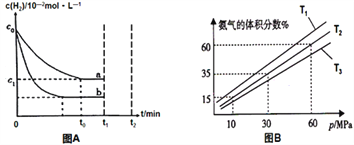
(2)某小组往一恒温恒压容器充入9 mol N2和23 mol H2模拟合成氨反应,图B为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图。若体系在T2、60MPa下达到平衡。
① 此时N2的平衡分压为__________MPa,H2的平衡分压为___________MPa。(分压=总压×物质的量分数)
② 列式计算此时的平衡常数Kp=____。(用平衡分压代替平衡浓度计算,结果保留2位有效数字)
(3)分离器中的过程对整个工业合成氨的意义是_____________________。
【答案】 (c0-c1)/300t0 增大c(N2)  9 15 0.043(Mpa)-2 及时分离出液氨,c(NH3)减小,使平衡往生成NH3的方向移动,增大原料利用率(或NH3产率)。
9 15 0.043(Mpa)-2 及时分离出液氨,c(NH3)减小,使平衡往生成NH3的方向移动,增大原料利用率(或NH3产率)。
【解析】(1)①a条件下,0~t0的平均反应速率v(N2)= ![]() v(H2)=
v(H2)= ![]() ×
×![]() =
=![]() ×
×![]() =
=![]() mol/(L·min),故答案为:
mol/(L·min),故答案为: ![]() ;
;
②a、b氢气起始浓度相同,b到达平衡的时间缩短,说明反应速率增大,平衡时氢气的浓度减小,说明平衡正向移动,所以改变的条件是增大c(N2),故答案为:增大c(N2);
③在a条件下t1时刻将容器体积压缩至原来的![]() ,t2时刻重新建立平衡状态,t1时刻变成2c1,t1~t2时刻的趋势逐渐减小,终点达到新的平衡时浓度大于c1,
,t2时刻重新建立平衡状态,t1时刻变成2c1,t1~t2时刻的趋势逐渐减小,终点达到新的平衡时浓度大于c1, ,故答案为:
,故答案为: ;
;
(2)①若体系在T2、60MPa下达到平衡,相同温度下,气体的体积分数等于其物质的量分数,
设平衡时n(NH3)=xmol,
N2(g)+3H2(g) ![]() 2NH3(g)
2NH3(g)
开始(mol) 923 0
反应(mol) 0.5x1.5x x
平衡(mol)9-0.5x 23-1.5x x
平衡时氨气体积分数=![]() ×100%=60%,x=12,氮气分压=
×100%=60%,x=12,氮气分压=![]() ×60MPa=9MPa;氨气的分压=60%×60MPa=36MPa,氢气分压=60MPa-9MPa-36MPa=15MPa,此时的平衡常数Kp=
×60MPa=9MPa;氨气的分压=60%×60MPa=36MPa,氢气分压=60MPa-9MPa-36MPa=15MPa,此时的平衡常数Kp= =0.043(MPa)-2,故答案为:9;15;0.043(MPa)-2;
=0.043(MPa)-2,故答案为:9;15;0.043(MPa)-2;
(3)分离器中的过程是分离出氨气促进平衡正向进行,及时分离出液氨,c(NH3)减小,使平衡往生成NH3的方向移动,增大原料利用率(或NH3产率);故答案为:及时分离出液氨,c(NH3)减小,使平衡往生成NH3的方向移动,增大原料利用率(或NH

【题目】研究催化剂对化学反应有重要意义。为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:
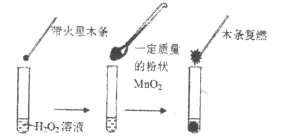
(1)甲同学欲用下图所示实验来证明![]() 是
是![]() 分解反应的催化剂。该实验________(填“能”或“不能”)达到目的,原因是___________。
分解反应的催化剂。该实验________(填“能”或“不能”)达到目的,原因是___________。
(2)为探究![]() 的量对催化效果的影响,乙同学分别量取
的量对催化效果的影响,乙同学分别量取![]() 1%
1%![]() 加入容器中,在一定质量范围内,加入不同质量的
加入容器中,在一定质量范围内,加入不同质量的![]() ,测量所得气体体积,数据如下:
,测量所得气体体积,数据如下:
| 0.1 | 0.2 | 0.4 |
40s末 | 49 | 61 | 86 |
由此得出的结论是______________。
(3)为分析![]() 和
和![]() 对
对![]() 分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有
分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有![]() )
)
试管 | I | II | III |
滴加试剂 | 5滴 | 5滴 | 5滴0.3 |
产生气泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
结论是___________,实验III的目的是___________。
(4)①查阅资料得知:将作为催化剂的![]() 溶液加入
溶液加入![]() 溶液后,溶液中会发生两个氧化还原反应,且两个反应中
溶液后,溶液中会发生两个氧化还原反应,且两个反应中![]() 均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是__________和___________(按反应发生的顺序写)。
均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是__________和___________(按反应发生的顺序写)。
②在上述实验过程中,分别检测出溶液中有二价锰、二价铁和一价铜,由此得出选择作为![]() 分解反应的催化剂需要满足的条件是___________。
分解反应的催化剂需要满足的条件是___________。