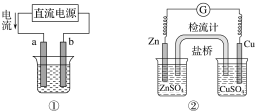
题目内容
【题目】氮及其化合物在生产,生活中有着重要的作用。
(1)将大气中游离态的氮转为化合态的过程称为氮的固定。下表列举了不同温度下大气固氮和工业固氮的部分K值。
反应 | 大气固氮 | 工业固氮 | |||
温度/℃ | 27 | 2000 | 25 | 400 | 450 |
K |
| 0.1 |
| 0.507 | 0.152 |
分析数据可知:大气固氮反应属于_________(填“吸热”或“放热”)反应,人类不适合大规模模拟大气固氮的原因是______________________________________。
(2)液氨是一种良好的储氢物质,其储氢容量可达17.6%(质量分数)。氨气分解反应的热化学方程式如下:![]() 。研究表明金属催化剂可加速氨气的分解,其他条件相同,该反应在不同催化剂作用下反应相同时间后,氮气的百分含量随反应温度的变化如图所示,图中达到平衡的点是_______________(用a、b、c表示)。b点氮气的百分含量高于c点的原因是______。
。研究表明金属催化剂可加速氨气的分解,其他条件相同,该反应在不同催化剂作用下反应相同时间后,氮气的百分含量随反应温度的变化如图所示,图中达到平衡的点是_______________(用a、b、c表示)。b点氮气的百分含量高于c点的原因是______。

(3)近年来,有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为![]() ,该条件下,向一体积为
,该条件下,向一体积为![]() 的恒容密闭容器中通入
的恒容密闭容器中通入![]() 和
和![]() ,
,![]() 后达到平衡。测得氨气的生成速率
后达到平衡。测得氨气的生成速率![]() ,则平衡时
,则平衡时![]() 的转化率为______________,则常温下该反应的化学平衡常数
的转化率为______________,则常温下该反应的化学平衡常数![]() ________________。(保留小数点后2位)
________________。(保留小数点后2位)
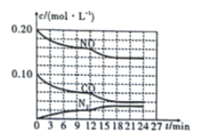
(4)汽车尾气会排放氮的氧化物,是造成雾霾天气的重要原因之一。可以在汽车排气管上安装一个化转化器处理尾气:![]() ,将
,将![]() 与
与![]() 以2∶1的起始投料比充入一个密闭容器中,发生反应,反应过程中各物质的浓度变化如图所示。由图分析可知,第
以2∶1的起始投料比充入一个密闭容器中,发生反应,反应过程中各物质的浓度变化如图所示。由图分析可知,第![]() 时改变的反应条件可能为____________(填序号)。
时改变的反应条件可能为____________(填序号)。
A.保持恒温恒容充入![]() 气
气
B.保持恒容,降低温度
C.移走![]()
D.保持恒温,缩小容器体积,增大压强
【答案】吸热 K值小,正向进行的程度小(或转化率低),不适合大规模生产 a 相同条件下,![]() 的催化效果更好,b点的反应速率更快 50% 1.69 BC
的催化效果更好,b点的反应速率更快 50% 1.69 BC
【解析】
(1)①温度越高,K越大,说明升高温度,平衡正移;K值很小,转化率很小;
(2)用控制变化法分析;
(3)利用结合数据,利用“三段式”计算平衡常数;
(4)12min时改变条件瞬间各组分浓度不变,而氮气浓度增大,NO、CO浓度减小,平衡正向移动,结合平衡移动原理分析解答。
(1)由表格数据可知,温度越高,K越大,说明升高温度,平衡正移,则正反应方向为吸热反应;由表格数据可知,2000℃时,K=0.1,K值很小,则转化率很小,不适合大规模生产,所以人类不适合大规模模拟大气固氮;
(2)根据图像显示,不论何种催化剂,当达到a点时,氮气的百分含量保持不变,a达到平衡状态,b、c点均未达到平衡;有图像可知,相同条件下,![]() 的催化效果更好,b点的反应速率更快;
的催化效果更好,b点的反应速率更快;
(3)![]() 后达到平衡。测得氨气的生成速率
后达到平衡。测得氨气的生成速率![]() ,则根据v=
,则根据v=![]() ,则氨气的浓度变化量=0.2mol/(Lmin)×5min=1mol/L,列“三段式”:
,则氨气的浓度变化量=0.2mol/(Lmin)×5min=1mol/L,列“三段式”:

则平衡时![]() 的转化率为
的转化率为![]() ×100%=50%,常温下该反应的化学平衡常数K=
×100%=50%,常温下该反应的化学平衡常数K= =1.69;
=1.69;
(4)12min时改变条件瞬间各组分浓度不变,而氮气浓度增大,NO、CO浓度减小,平衡正向移动,正反应为放热反应;
A.保持恒温恒容充入![]() 气,体系中各组分的浓度不变,平衡不移动,故A不符合图像;
气,体系中各组分的浓度不变,平衡不移动,故A不符合图像;
B.保持恒容,降低温度,平衡正向移动,而氮气浓度增大,NO、CO浓度减小,故B符合图像;
C.移走![]() ,平衡正向移动,而氮气浓度增大,NO、CO浓度减小,故C符合图像;
,平衡正向移动,而氮气浓度增大,NO、CO浓度减小,故C符合图像;
D.保持恒温,缩小容器体积,体系中各组分的浓度瞬间增大,增大压强,平衡向正向移动,故D不符合图像;
答案选BC。

 初中学业考试导与练系列答案
初中学业考试导与练系列答案