题目内容
【题目】设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.![]() 含有的电子数为11NA
含有的电子数为11NA
B.![]() 的
的![]() 溶液中氮原子数等于0.6NA
溶液中氮原子数等于0.6NA
C.常温下,![]() 与
与![]() 混合气体中氧原子数为2NA
混合气体中氧原子数为2NA
D.硫酸铵中既含有离子键,又含有共价键,而氯化铵中只含有离子键
【答案】B
【解析】
A.铵根离子为10电子微粒,故1mol铵根离子中含10mol电子即10NA个,故A错误;
B.溶液中硝酸铵的物质的量m=cV=3mol/L×0.1L=0.3mol,而1mol硝酸铵中含2mol氮原子,故0.3mol硝酸铵中含0.6mol氮原子即0.6NA个,故B正确;
C.NO2和N2O4的最简式均为NO2,故92g混合物中的NO的物质的量n=![]() =2mol,故含有4mol氧原子即4NA个,故C错误;
=2mol,故含有4mol氧原子即4NA个,故C错误;
D.铵盐均为离子化合物。铵根离子中N和H之间为共价键,故硫酸铵和氯化铵中均既含离子键又含共价键,故D错误;
答案选B。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
【题目】氮及其化合物在生产,生活中有着重要的作用。
(1)将大气中游离态的氮转为化合态的过程称为氮的固定。下表列举了不同温度下大气固氮和工业固氮的部分K值。
反应 | 大气固氮 | 工业固氮 | |||
温度/℃ | 27 | 2000 | 25 | 400 | 450 |
K |
| 0.1 |
| 0.507 | 0.152 |
分析数据可知:大气固氮反应属于_________(填“吸热”或“放热”)反应,人类不适合大规模模拟大气固氮的原因是______________________________________。
(2)液氨是一种良好的储氢物质,其储氢容量可达17.6%(质量分数)。氨气分解反应的热化学方程式如下:![]() 。研究表明金属催化剂可加速氨气的分解,其他条件相同,该反应在不同催化剂作用下反应相同时间后,氮气的百分含量随反应温度的变化如图所示,图中达到平衡的点是_______________(用a、b、c表示)。b点氮气的百分含量高于c点的原因是______。
。研究表明金属催化剂可加速氨气的分解,其他条件相同,该反应在不同催化剂作用下反应相同时间后,氮气的百分含量随反应温度的变化如图所示,图中达到平衡的点是_______________(用a、b、c表示)。b点氮气的百分含量高于c点的原因是______。

(3)近年来,有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为![]() ,该条件下,向一体积为
,该条件下,向一体积为![]() 的恒容密闭容器中通入
的恒容密闭容器中通入![]() 和
和![]() ,
,![]() 后达到平衡。测得氨气的生成速率
后达到平衡。测得氨气的生成速率![]() ,则平衡时
,则平衡时![]() 的转化率为______________,则常温下该反应的化学平衡常数
的转化率为______________,则常温下该反应的化学平衡常数![]() ________________。(保留小数点后2位)
________________。(保留小数点后2位)
(4)汽车尾气会排放氮的氧化物,是造成雾霾天气的重要原因之一。可以在汽车排气管上安装一个化转化器处理尾气:![]() ,将
,将![]() 与
与![]() 以2∶1的起始投料比充入一个密闭容器中,发生反应,反应过程中各物质的浓度变化如图所示。由图分析可知,第
以2∶1的起始投料比充入一个密闭容器中,发生反应,反应过程中各物质的浓度变化如图所示。由图分析可知,第![]() 时改变的反应条件可能为____________(填序号)。
时改变的反应条件可能为____________(填序号)。
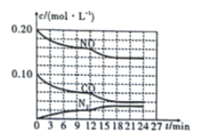
A.保持恒温恒容充入![]() 气
气
B.保持恒容,降低温度
C.移走![]()
D.保持恒温,缩小容器体积,增大压强